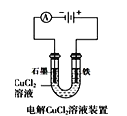
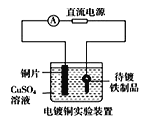
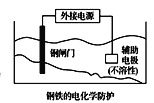
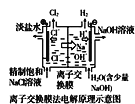
题目内容
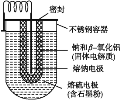
【题目】给你提供纯锌、纯铜片和500 mL 0.2 mol·L-1的H2SO4溶液、导线、1000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。

(1)如图所示,装置气密性良好,且1000 mL量筒中已充满了水,则开始实验时,a电极材料为________,其电极反应式为________。b电极材料为________,其电极反应式为________。
(2)当量筒中收集到672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为__________。
【答案】纯锌片 Zn-2e-=Zn2+ 纯铜片 2H++2e-=H2↑ 0.06 mol
【解析】
(1)活泼失电子的金属锌作负极,发生氧化反应,铜作正极,发生还原反应;
(2)根据电极反应式进行计算;
(1)锌、铜、硫酸原电池中,纯锌片是负极,电极反应:Zn-2e-=Zn2+,铜是正极,该极上电极反应为:2H++2e-=H2↑,该装置右侧放出H2,则b电极材料为纯铜片,故答案为:纯锌片;Zn-2e-=Zn2+;纯铜片;2H++2e-=H2↑;
(2)正极上电极反应为:2H++2e-=H2↑,当量筒中收集到672ml即标况下0.03mol氢气时,转移电子是0.06mol,故答案为:0.06mol。

 习题精选系列答案
习题精选系列答案【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
【题目】对于反应:2SO2+O2![]() 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3速率 |
① | 升高温度 | ________ |
② | 降低温度 | ________ |
③ | 增大氧气浓度 | ________ |
④ | 使用催化剂 | ________ |
⑤ | 压缩体积 | ________ |
【题目】下表所列各组物质中,能一步实现如图所示各步转化关系的是( )

选项 | X | Y | Z | W |
A | Fe3O4 | Fe | FeCl2 | FeCl3 |
B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
C | NH3 | NO | NO2 | HNO3 |
D | Si | SiO2 | H2SiO3 | Na2SiO3 |
A.AB.BC.CD.D