题目内容
【题目】下列图示变化为吸热反应的是
A.
B.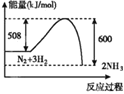
C.
D.
【答案】A
【解析】
反应物的总能量大于生成物的总能量的反应为放热反应,反应物的总能量小于生成物的总能量的反应为吸热反应。常见的放热反应有:燃烧、金属与酸反应、金属与水反应、酸碱中和反应、铝热反应和绝大多数化合反应等;常见的吸热反应有:绝大数分解反应、某些化合反应(如碳与二氧化碳的反应)、碳与水蒸气的反应、氯化铵晶体与Ba(OH)2·8H2O的反应等。
A.图中反应物的总能量较低生成物的总能量较高,则该反应为吸热反应,A正确;
B.图中反应物的总能量较高生成物的总能量较低,则该反应为放热反应,B错误;
C.浓硫酸溶于水放热,但过程中没有发生化学变化,不符合题意,C错误;
D.活泼金属与酸的反应是放热反应,不符合题意,D错误;
故选A。

【题目】醇脱水是制取烯烃的常用方法,实验室以环己醇为原料制取环己烯的实验装置如图所示。
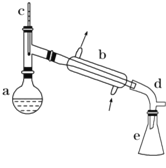
反应的化学方程式:
合成反应:
在a中加入40g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯20g。
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
回答下列问题:
(1)装置b的名称是___________
(2)加入碎瓷片的作用是_________
(3)本实验中最容易产生的副反应的化学方程式为______________
(4)分离提纯过程中加入无水氯化钙的目的是________________
(5)本实验所得到的环己烯产率是____(填正确答案标号)
A.41% B.50% C.61% D.70%
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |

