题目内容
17.在25℃时,分别用pH=9、pH=10的两种NaOH溶液中和同浓度、同体积的盐酸,消耗NaOH溶液的体积分别为V1和V2,则V1和V2的关系是( )| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
分析 根据pH表示出溶液中的OH-浓度,再根据n=cV表示出OH-的物质的量,同浓度、同体积的盐酸中H+的物质的量相等,发生反应:H++OH-=H2O,则pH不同的NaOH溶液中OH-的物质的量相等.
解答 解:pH=9的NaOH溶液中OH-浓度为$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,pH=10的NaOH溶液中OH-浓度为$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4mol/L,同浓度、同体积的盐酸中H+的物质的量相等,发生反应:H++OH-=H2O,则pH不同的NaOH溶液中OH-的物质的量相等,故V1×10-5mol/L=V2×10-4mol/L,整理可得:V1=10V2,故选A.
点评 本题考查化学方程式有关计算,关键是根据发生的反应判断氢氧根离子物质的量关系.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
7.下列叙述中,正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
8.下列溶液中能发生水解的离子是( )
| A. | FeCl3溶液中的Cl- | B. | Na2CO3溶液中的CO32- | ||
| C. | 氯化钡溶液中的Ba2+ | D. | 氟化钠溶液中的F- |
12.下列物质中既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | ①②⑤ |
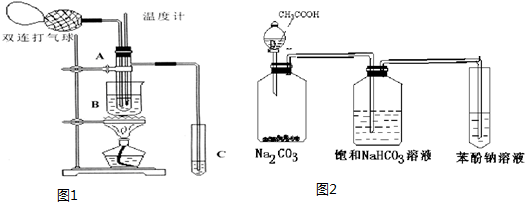
6.乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图1所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{68℃~80℃}^{cuo}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,
在实验开始时温度计水银球的位置应在试管A的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在在试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(4)若想检验试管C中是否含有产物乙酸,在下列提供的试剂和试纸中可以选用ad.(填序号).实验仪器任选.所提供的试剂和试纸有:
a.pH试纸 b.红色的石蕊试纸 c.白色的醋酸铅试纸 d.碳酸氢钠粉末.
(5)实验室可以用下列装置如图2来探究乙酸、苯酚、碳酸的酸性强弱.
①饱和碳酸氢钠溶液的作用是除去乙酸.
②苯酚钠溶液中应观察到溶液变浑浊,有关的化学方程式C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{68℃~80℃}^{cuo}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,
在实验开始时温度计水银球的位置应在试管A的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在在试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,②使生成的乙酸蒸气进入试管;烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(4)若想检验试管C中是否含有产物乙酸,在下列提供的试剂和试纸中可以选用ad.(填序号).实验仪器任选.所提供的试剂和试纸有:
a.pH试纸 b.红色的石蕊试纸 c.白色的醋酸铅试纸 d.碳酸氢钠粉末.
(5)实验室可以用下列装置如图2来探究乙酸、苯酚、碳酸的酸性强弱.
①饱和碳酸氢钠溶液的作用是除去乙酸.
②苯酚钠溶液中应观察到溶液变浑浊,有关的化学方程式C6H5ONa+CO2+H2O→C6H5OH↓+NaHCO3.