题目内容
7.下列叙述中,正确的是( )| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物的反应放出的热量;
B、反应是可逆反应,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),不能进行完全,反应的焓变是对应化学方程式物质全部反应时放出的热量;
C、相同条件下,2mol氢原子结合为1mol氢分子的过程是放热反应;
D、根据CH3COOH为弱酸电离要吸热分析.
解答 解:A、甲烷燃烧的热化学方程式中水是气体,不符合燃烧热的概念,故A错误;
B、反应是可逆反应,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),不能进行完全,反应的焓变是对应化学方程式物质全部反应时放出的热量,故B错误;
C、相同条件下,2mol氢原子结合为1mol氢分子的过程是放热反应,所以2mol氢原子所具有的能量大于1mol氢分子所具有的能量,故C错误;
D、CH3COOH为弱酸电离要吸热,所以1 molNaOH分别和1molCH3COOH、1mol HNO3反应,后者比前者放出的热量多,故D正确;
故选D.
点评 本题考查了燃烧热的概念应用和判断,可逆反应与焓变的关系和含义,反应自发进行的判断依据,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
18.下列物质中既能跟氢氧化钠反应又能跟盐酸反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | 全部 |
19.下面关于化学反应的限度的叙述中,正确的是( )
| A. | 不同化学反应的限度都相同 | |
| B. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| C. | 当一个可逆反应在一定条件下达到限度时,反应即停止 | |
| D. | 当一个可逆反应在一定条件下达到限度时,正反应速率与逆反应速率相等 |
16.实验室为监测空气中汞蒸汽的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:CuI+Hg→Cu2HgI4+Cu (未配平),当有1molCuI参与反应时,转移的电子为( )
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
17.在25℃时,分别用pH=9、pH=10的两种NaOH溶液中和同浓度、同体积的盐酸,消耗NaOH溶液的体积分别为V1和V2,则V1和V2的关系是( )
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
 .
.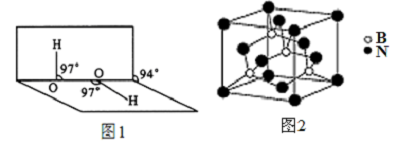
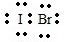 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子.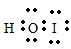 .
.
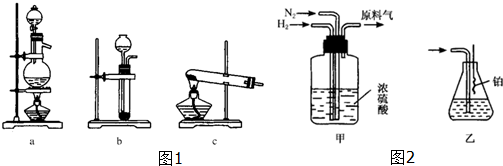

 .(不用写反应条件)
.(不用写反应条件)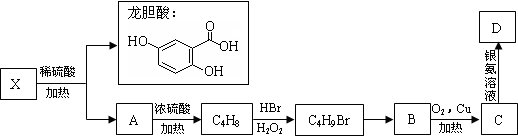
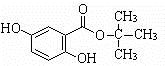 .
.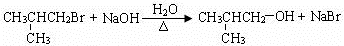 .(用结构简式表示)
.(用结构简式表示)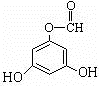 或
或 .
.