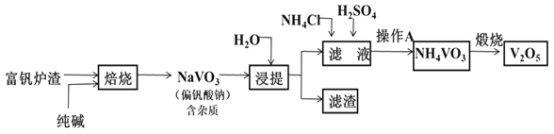
��Ŀ����
����Ŀ�������£�ijˮ��ҺM�д��ڵ�������Na+��A2-��HA-��H+��OH-��H2O��H2A����������ش��������⣺
(1)H2AΪ_____(����ǿ����������)�ᣬ��H2A��Һ�м�ˮ��ʹ ��ֵ_______ (����������������С������������)��
��ֵ_______ (����������������С������������)��
(2)��M����һ��������ɵ���Һ����
��M�����ʿ�����Na2A��_________��Na2A��ˮ��ҺpH__________ (����<������ >������=��)7
����Na2A��Һ�м���__________ (����ĸ)��������ˮ�⡣
A. �Ȼ�粒��� B. KOH ���� C. ˮ D. �����¶�
����֪Ksp(CuA)=1.3![]() 10-36����20mL1 mo1��L-1Na2A��Һ�м���10mL1 mo1��L-1CuCl2��Һ����Ϻ���Һ��Cu2+Ϊ____________mo1��L-1��(����A2-��ˮ��)
10-36����20mL1 mo1��L-1Na2A��Һ�м���10mL1 mo1��L-1CuCl2��Һ����Ϻ���Һ��Cu2+Ϊ____________mo1��L-1��(����A2-��ˮ��)
(3)����ҺM��10mL1.00 mo1��L-1H2A��Һ��10mL1.00mo1��L-1NaOH��Һ��϶��ɣ����й�����ҺM��˵����ȷ����______(����ĸ)��
A.c(A2-)+ c(HA-)+ c(H2A)=1 mo1��L-1
B.����Һ�����ԣ���c(Na+)>c(HA-)> c(H+)>c(A2-)>c(OH-)
C.����Ũ�ȹ�ϵ��c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D. 25��ʱ����ˮϡ�ͺ�n(H+)��n(OH-)�ij˻����
(4)Ũ�Ⱦ�Ϊ0.1 mo1��L-1��Na2A��NaHA�����Һ�У�![]() =______
=______
���𰸡��� ���� NaHA > B 3.9��10-36 BD 1.5
��������
(1)��Һ�д���H2A��HA����˵��H2AΪ���ᣬ��H2A��Һ�м�ˮ������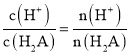 ������
������
(2)�����ں���Na+��A2����HA����H+��OH����H2O��H2A����˿ɵó�M�����ʣ�Na2A��ˮ��ҺA2��ˮ���Լ��ԣ�
����Na2A��Һˮ���Լ��ԣ�A. �Ȼ�粒�������ˮ�����ԣ�������ٽ���B. ����KOH���壬����ˮ�⣻C. ��ˮϡ�ͣ�ˮ�������ƶ����ٽ�ˮ�⣻D. �����¶ȣ�ˮ��ƽ�������ƶ����ٽ�ˮ�⣻
����20mL1 mo1��L-1Na2A��Һ�м���10mL 1 mo1��L-1CuCl2��Һ�����߷�Ӧ����CuA�������ȼ����Ϻ�c(A2��)���ٸ����ܶȻ�����ͭ����Ũ�ȡ�
(3)�ȵó���Ϻ�����Ϊ0.05 mo1��L-1NaHA��A. ���������غ������B. ����Һ�����ԣ�˵���������ˮ�⣬HA������ռ��Ҫ��C. ���ݵ���غ㣻D. 25��ʱ����ˮϡ�ͺ����ӻ��������䣬����Һ�������
(4)Ũ�Ⱦ�Ϊ0.1 mo1��L-1��Na2A��NaHA�����Һ�У����������غ�õ���
(1)��Һ�д���H2A��HA����˵��H2AΪ���ᣬ��H2A��Һ�м�ˮ������ƽ�������ƶ������������ʵ�������H2A���ʵ�����С�����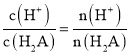 ��ֵ���ʴ�Ϊ����������
��ֵ���ʴ�Ϊ����������
(2)����M����һ��������ɵ���Һ�����ں���Na+��A2����HA����H+��OH����H2O��H2A�����M�����ʿ�����Na2A��NaHA��Na2A��ˮ��ҺA2��ˮ���Լ��ԣ����pH > 7���ʴ�Ϊ��NaHA��>��
����Na2A��Һˮ���Լ��ԣ�
A. �Ȼ�粒�������ˮ�����ԣ�������ٽ�����A���������⣻
B. ����KOH���壬����ˮ�⣬��B�������⣻
C. ��ˮϡ�ͣ�ˮ�������ƶ����ٽ�ˮ�⣬��C���������⣻
D. �����¶ȣ�ˮ��ƽ�������ƶ����ٽ�ˮ�⣬��D���������⣻
������������ΪB��
����20mL1 mo1��L-1Na2A��Һ�м���10mL 1 mo1��L-1CuCl2��Һ�����߷�Ӧ����CuA��������˻�Ϻ�c(A2��)= ![]() �������Һ��Cu2+Ϊ
�������Һ��Cu2+Ϊ ���ʴ�Ϊ��3.9��10-36��
���ʴ�Ϊ��3.9��10-36��
(3)����ҺM��10mL1.00 mo1��L-1H2A��Һ��10mL1.00mo1��L-1NaOH��Һ��ϣ�����Ϊ0.05 mo1��L-1NaHA��
A. ���������غ�õ�c(A2��)+ c(HA��)+ c(H2A)=0.5 mo1��L-1����A����
B. ����Һ�����ԣ�˵���������ˮ�⣬HA������ռ��Ҫ����c(Na+)>c(HA��)> c(H+)> c(A��) > c(OH��)����B��ȷ��
C. ���ݵ���غ�õ���c(Na+)+c(H+)=c(HA��)+2c(A2��)+c(OH��)����C����
D. 25��ʱ����ˮϡ�ͺ����ӻ��������䣬����Һ����������n(H+)��n(OH��)�ij˻��������ӻ�����������Һ�����ƽ�������n(H+)��n(OH��)�ij˻����D��ȷ��
������������ΪBD��
(4)Ũ�Ⱦ�Ϊ0.1 mo1��L-1��Na2A��NaHA�����Һ�У����������غ�![]() ���ʴ�Ϊ��1.5��
���ʴ�Ϊ��1.5��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����֪��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H��Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
CO2(g)��H2(g) ��H��Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
�¶�/�� | 400 | 500 | 850 |
ƽ�ⳣ�� | 9.94 | 9 | 1 |
��ش��������⣺
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ___���÷�Ӧ��Q__0(����������������)��
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O(g)������������Ӧ��CO��H2O(g)Ũ�ȱ仯��ͼ��ʾ����0��4 minʱƽ����Ӧ����v(CO)��__��
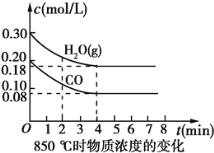
��3��400��ʱ��ѹǿ�㶨���ܱ������н���������Ӧ���ÿ��淴Ӧ�ﵽƽ��ı�־��__(����ĸ)��
A��v��(H2)��v��(CO)
B�������������������ʱ����仯
C�����������ܶȲ�����ʱ��仯
D��CO��H2O��CO2��H2�ķ�����֮��Ϊ1��1��1��1
��4������500��ʱ���У���CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020molL-1���������£�CO�����ת����Ϊ__��
��5������850��ʱ���У�ijʱ��ʱ���CO(g)��H2O(g)��CO2(g)��H2(g)�����ʵ����ֱ�Ϊ1mol��0.5mol��0.6mol��0.6mol����ʱV��__V����(��������������������=��)
��6������850��ʱ���У�����ʼʱCO��H2O(g)��Ϊ1mol������ˮ�������������Ϊx��ƽ��ʱCO��ת����Ϊy�����Ƶ�y��x�仯�ĺ�����ϵʽΪ__��