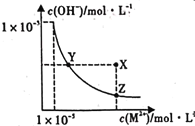
题目内容
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2mol O3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g) ΔH=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2mol O3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强P:P甲=P丙>2P乙
B.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.SO3的质量m:m甲=m丙>2m乙
【答案】D
【解析】
本题是一道反应前后气体分子数改变的等效平衡问题,等效平衡分为恒压和恒容两种情况,对于本题的恒容容器来讲,仅当反应前充入物质的量完全相等的反应物时才等效,因此甲、丙等效,乙中的气体较少,因此平衡要向气体数目增大的方向移动,即逆向移动,据此来分析即可。
A.根据分析甲、丙等效,因此![]() ,但是乙因为平衡逆向移动,气体分子数比甲容器的一半要多,因此
,但是乙因为平衡逆向移动,气体分子数比甲容器的一半要多,因此![]() ,A项错误;
,A项错误;
B.甲是正向进行的,丙是逆向进行的,虽然二者等效点是一样的,但是等效点不一定是转化率为50%的地方,因此![]() 。也可以理解为甲、丙两人从两地出发相向出发,虽然一定会碰面但是两人走过的路不一定相等,B项错误;
。也可以理解为甲、丙两人从两地出发相向出发,虽然一定会碰面但是两人走过的路不一定相等,B项错误;
C.三个容器中无论平衡如何移动,![]() 和
和![]() 的物质的量之比永远是2:1,因此
的物质的量之比永远是2:1,因此![]() ,C项错误;
,C项错误;
D.甲、丙等效,因此![]() ,乙因平衡逆向移动,所以
,乙因平衡逆向移动,所以![]() 的质量要小于甲中的一半,故
的质量要小于甲中的一半,故![]() ,D项正确;
,D项正确;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q__0(填“>”或“<”)。
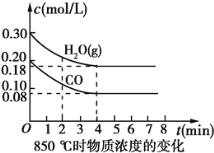
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=__。
(3)400℃时,压强恒定的密闭容器中进行上述反应。该可逆反应达到平衡的标志是__(填字母)。
A.v逆(H2)=v正(CO)
B.容器的总体积不再随时间而变化
C.混合气体的密度不再随时间变化
D.CO、H2O、CO2、H2的分子数之比为1∶1∶1∶1
(4)若在500℃时进行,且CO、H2O(g)的起始浓度均为0.020molL-1,该条件下,CO的最大转化率为__。
(5)若在850℃时进行,某时刻时测得CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1mol、0.5mol、0.6mol、0.6mol,此时V正__V逆。(填“>”或“<”或“=”)
(6)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为__。