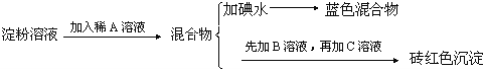
题目内容
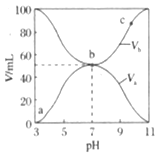
【题目】25℃时,向0.1molL-1HX溶液中逐渐加入NaOH固体,恢复至原温度后 与pH的关系如图所示(忽略溶液体积变化),下列有关叙述不正确的是
与pH的关系如图所示(忽略溶液体积变化),下列有关叙述不正确的是
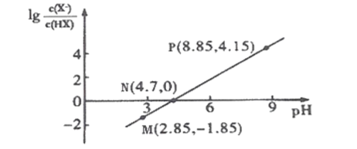
A.HX的Ka的数量级为10-5
B.P 点的溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
C.N 点的溶液中:c(Na+)+c(H+) = c(HX)+c(OH-)
D.M 点的溶液中:c(Na+)+c(HX) +c(H+) = 0.1 mol·L-1
【答案】D
【解析】
由N点可知,pH=4.7时,![]() =0,即c(H+)=10-4.7,
=0,即c(H+)=10-4.7,![]() =1,所以HX的平衡常数Ka=
=1,所以HX的平衡常数Ka=![]() ,HX是一元弱酸,据此解答。
,HX是一元弱酸,据此解答。
A.HX的平衡常数Ka=![]() =100.3×10-5,故HX的Ka的数量级为10-5,A正确;
=100.3×10-5,故HX的Ka的数量级为10-5,A正确;
B.电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-),P点,溶液pH=8.85,c(OH-)>c(H+),故c(Na+)>c(X-),所以c(Na+)>c(X-)>c(OH-)>c(H+),B正确;
C.电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-),N点,![]() =0,则
=0,则![]() =1,c(X-)=c(HX),所以c(Na+)+c(H+) = c(HX)+c(OH-),C正确;
=1,c(X-)=c(HX),所以c(Na+)+c(H+) = c(HX)+c(OH-),C正确;
D.电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-),物料守恒:c(X-)+c(HX)=0.1mol/L,联立二式有:c(Na+)+c(HX) +c(H+)–c(OH-)= 0.1 mol·L-1,D错误。
答案选D。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】H2O2作为绿色氧化剂被应用于废水处理、造纸和化学合成等行业。
(1)已知:H2(g)+![]() O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH1=-285.8kJ·mol-1
H2(g)+O2(g)=H2O2(l) ΔH2=-135.8kJ·mol-1
①H2(g)与O2(g)的反应中,在热力学上更有利的产物是__,原因是__。
②常温下,H2O2分解的热化学方程式为__。
(2)我国科学家使用Ag9团簇作催化剂,研究H2O2的合成。各步骤的活化能和反应热,如表所示,利用计算机模拟反应历程如图所示(TS表示过渡态,表示被催化剂吸附的物种)。
Ag9团簇上生成H2O2的活化能Ea和反应热![]()
步骤 | 过渡态 | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H—Ag9 | TS2 | 108.7 | -27.2 |
C | H—Ag9—H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

①通过降低步骤___(填字母)的能垒(活化能),可以较大幅度提高合成反应的速率。
②反应历程中2到3断裂的化学键为___(填序号)。
A.O2中的氧氧键 B.H2中的氢氢键 C.Ag9OOH中的氧氢键
(3)利用阴阳极同步放电产生H2O2和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极上放电的离子是___,阴极的电极反应式为___。

(4)常温下,H2O2分解速率方程v=0.0625·c(H2O2)mg·L-1·s-1,c(H2O2)随时间变化如下表:
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
分解时间(s) | 0 | 7 | 23 | 39 | 55 |
①当c(H2O2)=8000.0mg·L-1时,v=__mg·L-1·s-1;
②当c(H2O2)降为5000.0mg·L-1时,分解时间为___s。