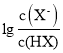题目内容
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。
已知:① CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
② CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
③ 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①要使该反应速率和产率都增大,应该采取的措施是__________________________________;。
②一定条件下,上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________(填标号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 变小
变小
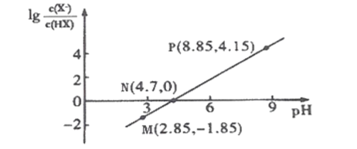
③在某压强下,制备二甲醚的反应在不同温度、不同投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则05 min内的平均反应速率υ(CH3OCH3)=__________;KA、 KB、 KC三者之间的大小关系为___________。

(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是_______________________________。
②CO的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释290℃后升高温度,CH3OCH3产率逐渐走低的原因可能是________________________________。
【答案】适当增大压强 b 0.036 mol·L-1·min-1 KA=KC>KB 2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 生成二甲醚的反应是放热反应,温度升高,平衡逆移,产率降低
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 生成二甲醚的反应是放热反应,温度升高,平衡逆移,产率降低
【解析】
(1)①要使该反应速率和产率都增大,则该条件可以使反应速率加快,也可以使平衡向正反应方向进行,据此进行分析;
②a.逆反应速率先增大后减小,可能是增大生成物浓度;
b.H2的转化率增大,平衡一定正向移动;
c.反应物的体积百分含量减小,可能是增大生成物浓度等;
d.容器中的![]() 值变小,可能是减小二氧化碳的物质的量;
值变小,可能是减小二氧化碳的物质的量;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,计算CO2的消耗量,再计算二甲醚的生成量,根据υ=![]() 计算平均反应速率;平衡常数仅与温度有关,温度不变,平衡常数不变,且在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大,平衡常数较大,据此解答;
计算平均反应速率;平衡常数仅与温度有关,温度不变,平衡常数不变,且在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大,平衡常数较大,据此解答;
(2)①根据已知信息先写出反应的化学方程式,再根据盖斯定律和已知热化学方程式进行计算;
②生成二甲醚的反应是放热反应,温度升高,平衡逆移,产率降低。
(1)①根据盖斯定律以及主反应方程式2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)可知,该反应可由反应①×2+③求得,则该反应的△H=2△H1+△H3 = -49.0kJ·mol-1×2 - 24.5 kJ·mol-1= -122.5 kJ·mol-1,反应为放热反应,且主反应为反应前后气体体积减小的反应,若要使产率增大,则需使平衡向右移动,可采取的措施为降温或增压,同时要使反应速率增大,则应该采取的措施为:适当增大压强;
CH3OCH3(g)+3H2O(g)可知,该反应可由反应①×2+③求得,则该反应的△H=2△H1+△H3 = -49.0kJ·mol-1×2 - 24.5 kJ·mol-1= -122.5 kJ·mol-1,反应为放热反应,且主反应为反应前后气体体积减小的反应,若要使产率增大,则需使平衡向右移动,可采取的措施为降温或增压,同时要使反应速率增大,则应该采取的措施为:适当增大压强;
故答案为:适当增大压强;
②逐项分析可知:
a. 逆反应速率先增大后减小,采取的措施可以是增大生成物浓度,平衡可以向逆反应方向移动,a项错误;
b.H2的转化率增大,说明同初始原料量的情况下H2已反应的量增大,能够说明平衡一定向正反应方向移动,b项正确;
c.反应物的体积百分含量减小,采取的措施可以是增大生成物浓度,则平衡可以向逆反应方向移动,c项错误;
d.容器中的![]() 变小,采取的措施可以是保证H2物质的量不变的情况下,减小CO2物质的量,则平衡可以向逆反应方向移动,d项错误;
变小,采取的措施可以是保证H2物质的量不变的情况下,减小CO2物质的量,则平衡可以向逆反应方向移动,d项错误;
故答案为:b;
③由图可知,T1温度下,将6molCO2和12molH2充入密闭容器中,投料比![]() ,则CO2的转化率为60%,则参与反应的CO2物质的量为n(CO2)= 6mol×60%=3.6mol,则生成二甲醚的物质的量为n(CH3OCH3)=1.8mol,则0~5min内的平均反应速率υ(CH3OCH3)=1.8mol÷10L÷5min=0.036mol/(L·min);同一可逆反应的平衡常数只与温度有关,温度相同平衡常数相同,A和C同在T1曲线上,KA=KC,在投料比相同的情况下,T2温度下B点的转化率小于T1温度下的转化率,则T2温度平衡常数较小,KA=KC>KB;
,则CO2的转化率为60%,则参与反应的CO2物质的量为n(CO2)= 6mol×60%=3.6mol,则生成二甲醚的物质的量为n(CH3OCH3)=1.8mol,则0~5min内的平均反应速率υ(CH3OCH3)=1.8mol÷10L÷5min=0.036mol/(L·min);同一可逆反应的平衡常数只与温度有关,温度相同平衡常数相同,A和C同在T1曲线上,KA=KC,在投料比相同的情况下,T2温度下B点的转化率小于T1温度下的转化率,则T2温度平衡常数较小,KA=KC>KB;
故答案为:0.036 mol·L-1·min-1;;KA=KC>KB;
(2)①根据已知条件,该反应的化学方程式为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),根据盖斯定律知,将①×2-②×2+③得该反应的△H=2△H1-2△H2+△H3,代入数据可知,△H=-204.7 kJ·mol-1,则该反应的热化学方程式为:2CO(g)+4H2(g)
CH3OCH3(g)+H2O(g),根据盖斯定律知,将①×2-②×2+③得该反应的△H=2△H1-2△H2+△H3,代入数据可知,△H=-204.7 kJ·mol-1,则该反应的热化学方程式为:2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1;
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1;
故答案为:2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1;
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1;
②分析图像可知,290℃后升高温度,CH3OCH3产率逐渐降低,由前述可知,生成二甲醚的反应是放热反应,温度升高,平衡逆移,产率降低;
故答案为:生成二甲醚的反应是放热反应,温度升高,平衡逆移,产率降低。

【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
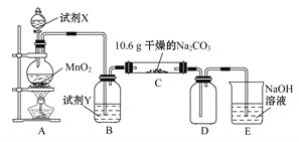
(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
【题目】T℃时,在2L的密闭容器中,气体X、Y、Z的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为_________________________.
(2)0~10s内,X的化学反应速率为___________________.
(3)该反应在不同温度下的平衡常数如表所示:
T/℃ | 100 | 220 | 830 | 1000 | 1200 |
K | 45.00 | 32.00 | 1.00 | 0.60 | 0.38 |
则该反应的ΔH__________0 (填“>”、“<”或“=”)
(4)830℃时,在容积为10L的恒容密闭容器中充入5molX气体、7.8molY气体和7.1mol Z气体,此时υ(正)_______υ(逆) (填“>”、“<”或“=”)
(5)上图所示反应的温度为_________________。