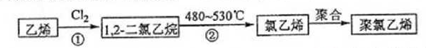
题目内容
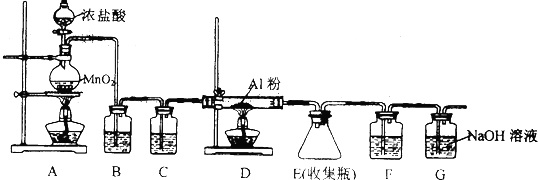
10.为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图1所示的实验装置,按要求回答问题: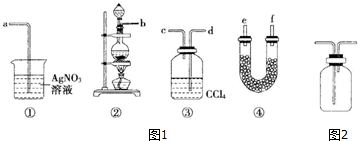
(1)请根据甲同学的意图,连接相应的装置,接口顺序:b接e,f接d,c接a.
(2)U形管中所盛试剂的化学式为无水CuSO4.
(3)装置③中CCl4的作用是吸收Cl2.
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加如图2的装置.你认为如图2的装置应加在③①之间(填装置序号).瓶中可以放入湿润的淀粉KI试纸(或湿润的有色布条).
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液.你认为可将溶液换成紫色石蕊试液,如果观察到紫色石蕊试液变红而不退色现象,则证明制Cl2时有HCl挥发出来.
分析 (1)分析装置可知装置①是制备氯气的发生装置,①过装置④中的硫酸铜检验是否有水生成,通过装置③的四氯化碳吸收氯气,剩余气通过硝酸银溶液吸收HCl生成白色沉淀说明气体中含有氯化氢气体;
(2)实验室常用无水硫酸铜检验水的存在;
(3)氯气易溶于四氯化碳溶液;
(4)G装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰;
(5)气体通过紫色石蕊试液变红而不退色,证明制Cl2时有HCl挥发出来.
解答 解:(1)分析装置可知装置①是制备氯气的发生装置,①过装置④中的硫酸铜检验是否有水生成,通过装置③的四氯化碳吸收氯气,剩余气通过硝酸银溶液吸收HCl生成白色沉淀说明气体中含有氯化氢气体,连接相应的装置,接口顺序:befdca,
故答案为:efdca;
(2)无水硫酸铜与水反应生成蓝色五水合硫酸铜晶体,可用来检验水,
故答案为:无水CuSO4;
(3)氯气易溶于四氯化碳溶液,可用来吸收氯气,
故答案为:吸收Cl2;
(4)①装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰,在③吸收氯气之后要检验氯气是否完全除去,根据氯气具有强氧化性的性质,可用湿润的淀粉KI试纸检验,如不变色,说明已经完全除去,
故答案为:③、①;湿润的淀粉KI试纸(或湿润的有色布条);
(5)将原来烧杯中的AgNO3溶液换成石蕊试液,气体通过紫色石蕊试液变红而不退色,证明制Cl2时有HCl挥发出来,
故答案为:紫色石蕊试液,紫色石蕊试液变红而不退色.
点评 本题考查氯气的制取原理、实验装置评价与理解、氯气的性质、氯离子检验等,难度不大,关键是清楚实验的目的与原理实验室制备氯气的实验分析,物质性质的实验验证方法设计和分析判断,反应现象是胶体关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.有下列10种物质分为两组:
A组:①苯酚,②乙酸,③牛油,④丙氨酸,⑤乙酸乙酯;
B组:⑥溴水,⑦甲醛,⑧苛性钠溶液,⑨氯化铁溶液,⑩金属钠.
A组物质中有一种跟B组物质均能反应,B组物质中有1种跟A组物质均能反应,则这两种物质分别是( )
A组:①苯酚,②乙酸,③牛油,④丙氨酸,⑤乙酸乙酯;
B组:⑥溴水,⑦甲醛,⑧苛性钠溶液,⑨氯化铁溶液,⑩金属钠.
A组物质中有一种跟B组物质均能反应,B组物质中有1种跟A组物质均能反应,则这两种物质分别是( )
| A. | ①⑧ | B. | ③⑩ | C. | ①⑥ | D. | ②⑨ |
19.下列装置示意图中的实验不能达到目的是( )
| A. | 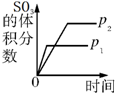 研究压强对反应的影响(p2>p1) | |
| B. |  研究温度对反应的影响 | |
| C. |  研究平衡体系中增加O2浓度对反应的影响 | |
| D. |  体积恒定的密闭容器中催化剂对反应的影响 |
17.对于平衡体系:aA(g)+bB(g)?cC(s)+dD(g);△H<0,有下列判断,其中不正确的是( )
| A. | 若容器容积不变,升高温度,各气体的相对分子质量一定增大 | |
| B. | 若从正反应开始,平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 达到平衡时,有amol A消耗的同时有b mol B生成 | |
| D. | 若容器为体积不变的密闭容器且a+b=c+d,则当升高容器内温度时平衡向左移动,容器中气体的压强增大 |
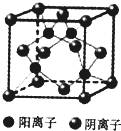 T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
 如图是某学生绘制的实验室蒸馏石油的装置图:
如图是某学生绘制的实验室蒸馏石油的装置图: