题目内容
18.有原子序数依次增大的五种短周期元素A、B、C、D、E,已知 A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素,每种元素都能与D元素形成原子个数比不相同的常见化合物,回答下列问题:(1)B在周期表中的位置是第二周期第ⅣA族,C元素的单质的电子式

(2)写出同时含A、B、C、D四种元素的一种盐的化学式NH4HCO3(或CH3COONH4)
(3)E和D形成的一种化合物与BD2发生氧化还原反应,该反应的方程式为2Na2O2+2CO2=2Na2CO3+O2
(4)在一定条件下,一定量的A的单质与C的单质反应,可生成17克气体化合物CA3,同时放出46kJ的热量,写出该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1
该反应为可逆反应,在体积不变的反应装置中,下列关于此反应的说法中正确的是AC
A.其它条件不变,加压可使该反应的反应速率变大
B.反应体系中反应物和生成物的总质量不变,说明该反应达到平衡状态
C.单位时间内生成1mol A的单质,同时消耗3molC的单质,说明该反应达到平衡状态.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,A元素的原子半径最小,则A为H元素;
B元素原子的最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则内层电子数为2,最外层电子数为4,故B为C盐酸;
C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,Y为硝酸铵,则C为N元素;
A、E同主族,根据原子序数大小可知E为Na元素;
A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,则D为O元素,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,A元素的原子半径最小,则A为H元素;B元素原子的最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则内层电子数为2,最外层电子数为4,故B为C盐酸;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,Y为硝酸铵,则C为N元素;A、E同主族,根据原子序数大小可知E为Na元素;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,则D为O元素,
(1)B为C元素,其原子序数为6,位于元素周期表中的第二周期第ⅣA族;C为N元素,对应单质为氮气,氮气分子中存在氮氮三键,氮气的电子式为: ,
,
故答案为:第二周期第ⅣA族; ;
;
(2)盐是由阳离子与酸根离子构成,A、B、C、D四种元素的两种盐的阳离子只能为铵根离子,则盐为NH4HCO3、CH3COONH4,
故答案为:NH4HCO3(或CH3COONH4);
(3)BD2为CO2,E和D形成的一种化合物能够与二氧化碳发生氧化还原反应,则该化合物为过氧化钠,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)氮气与氢气生成17g氨气放出46kJ的热量,则生成2molNH3放出92kJ的热量,该反应的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1;
A.该反应前后都是气体,故其它条件不变,增大压强,该反应的反应速率变大,故A正确;
B.根据质量守恒,反应体系中反应物和生成物的总质量始终不变,无法根据总质量判断该反应是否达到平衡状态,故B错误;
C.单位时间内生成1mol A的单质,同时消耗3molC的单质,说明正逆反应速率相等,则该反应达到平衡状态,故C正确;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1;AC.
点评 本题考查位置、结构、性质关系的综合应用,题目难度中等,正确推断各元素的名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系.

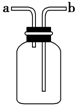
| A. | 洗气装置:瓶内放一定体积溶液,由a管口进气 | |
| B. | 收集不溶于水的气体:瓶内充满水,由b管口进气 | |
| C. | 排空气法收集氧气:由a管口进气 | |
| D. | 排空气法收集氢气:由a管口进气 |
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
| A. | CH3-CH2-COOH | B. | CH2=CH-CH2-OH | C. | CH2=CH-COOH | D. | CH2=CH-COOCH3 |
| A. | 风力发电 | B. | 潮汐能发电 | ||
| C. | 水力发电 | D. | 太阳能光解水制取H2 |



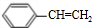 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于