题目内容
4.用pH=4和pH=11的强酸和强碱混合,使pH=10,则两溶液的体积比为9:2.分析 pH=4的强酸溶液中c(H+)=0.0001mol/L,pH=11的强碱溶液中c(OH-)=0.001mol/L,混合液的pH=0,则混合溶液中c(OH-)=10-4mol/L=$\frac{c(O{H}^{-}){V}_{碱}-c({H}^{+}){V}_{酸}}{{V}_{酸}+{V}_{碱}}$,据此计算酸碱体积之比.
解答 解:pH=4的强酸溶液中c(H+)=0.0001mol/L,pH=11的强碱溶液中c(OH-)=0.001mol/L,混合液的pH=0,则混合溶液中c(OH-)=10-4mol/L=$\frac{c(O{H}^{-}){V}_{碱}-c({H}^{+}){V}_{酸}}{{V}_{酸}+{V}_{碱}}$=$\frac{0.001×{V}_{碱}-0.0001×{V}_{酸}}{{V}_{酸}+{V}_{碱}}$,解得:V酸:V碱=9:2,
故答案为:9:2.
点评 本题考查了pH的简单计算,根据混合溶液中氢氧根离子浓度计算公式进行计算即可,注意溶液酸碱性与溶液pH的关系,题目难度不大.试题侧重基础知识的考查.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
14.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | X2Y |
9.已知X、Y、M、N之间的转化关系如图所示.下列说法正确的是( )
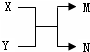

| A. | 若X为Fe,N为氢气,则Y一定为酸 | |
| B. | 若X、N为化合物,Y为水,则M一定是气体单质 | |
| C. | 若X、Y、M、N均为化合物,该反应一定属于复分解反应 | |
| D. | 若X、Y、M、N均为10电子微粒,且M是工业生产HNO3的一种原料气,则N常温下一定呈液态 |
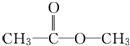 、
、 或
或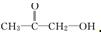 .
.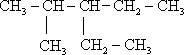 ;
;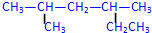 2,4-二甲基己烷
2,4-二甲基己烷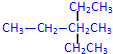 3-甲基-3-乙基戊烷
3-甲基-3-乙基戊烷 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$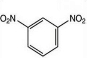 +2H2O.
+2H2O.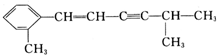 该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
 .
. ,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为
,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为 .
.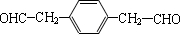 (写一种即可).
(写一种即可). 单体的结构简式为
单体的结构简式为 ;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式
;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式 .
.
 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙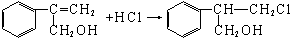 (不需注明反应条件).
(不需注明反应条件).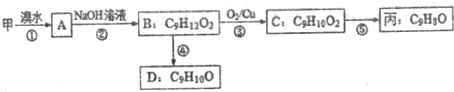
 .
. 、
、 、
、 (其中一种).
(其中一种).