题目内容
12.短周期元素R、T、X、Y、Z在元素周期表的相对位置如图所示,它们的最外层电子数之和为24.则下列判断正确的是( )| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VA族 | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | 气态氢化物稳定性:Y>T | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
分析 由短周期元素R、T、X、Y、Z在元素周期表的相对位置知,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则T、Y的最外层电子数为x+1,Z的最外层电子数为x+2,它们的最外层电子数之和为24,则2x+2(x+1)+x+2=24,解得x=4,则R为C,X为Si,T为N,Y为P,Z为S,然后结合元素性质及周期律来解答.
解答 解:由短周期元素R、T、X、Y、Z在元素周期表的相对位置知,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则T、Y的最外层电子数为x+1,Z的最外层电子数为x+2,它们的最外层电子数之和为24,则2x+2(x+1)+x+2=24,解得x=4,则R为C,X为Si,T为N,Y为P,Z为S.
A.C元素位于元素周期表中第二周期第ⅣA族,故A错误;
B.C能分别与Si、S形成共价化合物SiC、CS2,故B正确;
C.气态氢化物稳定性:NH3>PH3,故C错误;
D.S元素的最高价氧化物对应的水化物的化学式为H2SO4,故D错误,
故选:B.
点评 本题考查位置结构性质的关系及应用,元素的推断为解答的关键,注意利用元素的位置及最外层电子数推断元素,题目难度不大.

练习册系列答案
相关题目
3.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2=CHCN | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
20.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的氧化铜粉末 | B. | 二氧化碳通过过氧化钠粉末 | ||
| C. | 铝与氧化铁发生铝热反应 | D. | 将锌粒投入硝酸铜溶液中 |
7.现有物质的量浓度均为0.1mol•L-1的四种溶液各25mL:①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是( )
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25 mL 0.1 mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5 mL 0.1mol•L-1 NaOH溶液后,两溶液中离子种类相同 |
4. 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
1.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA | |
| B. | 0.1mol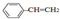 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA | |
| C. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
2.某有机物的结构简式如图所示.下列关于该有机物的叙述错误的是( )


| A. | 分子式为C12H14O3 | B. | 分子中含有三种含氧官能团 | ||
| C. | 能够发生加成反应和取代反应 | D. | 可使溴水和酸性高锰酸钾溶液褪色 |
 $→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D
$→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D


 +2NaBr.
+2NaBr.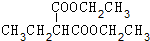 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.

 .
.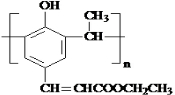 .
.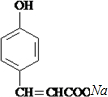 +
+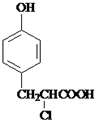 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.