题目内容
9.将足量的CO2通入下列溶液中,最终溶液浑浊的是( )①饱和苏打溶液 ②水玻璃 ③氯化钡 ④次氯酸钙.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①②③④ |
分析 先判断反应是否发生,再根据生成物的溶解性进行判断,难溶性的物质会产生沉淀,白色沉淀有:硅酸、碳酸氢钠晶体、难溶的碳酸盐等,以此解答.
解答 解:①苏打溶液为碳酸钠溶液,饱和碳酸钠溶液和二氧化碳反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则生成沉淀,故①正确;
②水玻璃是硅酸钠溶液,向Na2SiO3溶液中通入过量CO2会生成硅酸沉淀,故②正确;
③向BaCl2溶液中通入少量的CO2不会发生反应,无沉淀出现,故③错误;
④向Ca(ClO)2溶液通入过量CO2会生成次氯酸和碳酸氢钙,没有沉淀,故④错误;
故选A.
点评 本题考查物质之间的化学反应,掌握元素及其化合物的性质,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意注意通入的过量二氧化碳能否与产物继续反应是该题易错点,题目难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
2.关于下列说法错误的是( )
| A. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| B. | 绿矾、碱石灰、苏打、干冰分别属于纯净物、混合物、电解质、非电解质 | |
| C. | 乙烯水化、铁铝钝化、植物油氢化、纯碱晶体风化等过程中都包含化学变化 | |
| D. | 蛋白质、纤维素、硝化纤维等都是高分子化合物 |
1.某二元酸(化学式H2A)在水中的电离方程式是H2A→H++HA-、HA?H++A2-又知0.1mol/L NaHA溶液的pH=2.则下列说法不正确的是( )
| A. | 因为A2-+H2O?HA-+OH-,所以Na2A溶液显碱性 | |
| B. | 0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L | |
| C. | NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 在NaHA溶液中,HA-电离的趋势大于其水解的趋势 |
18.室温下,用含 0.2mol NaOH的溶液恰好吸收0.2mol NO2后所得溶液为1L,反应的化学方程式为2NO2+2NaOH→NaNO3+NaNO2+H2O.对反应后的溶液,下列说法正确的是[已知:Ka(HNO2)=7.1×10-4、Ka(CH3COOH)=1.7×10-5]( )
| A. | n(NO2-)+n(OH-)-n(H+)=0.1 mol | |
| B. | 若加入少量CH3COONa固体,溶液的碱性会减弱 | |
| C. | 若再通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) | |
| D. | 此时溶液的pH大于0.1 mol•L-1的CH3COONa溶液 |
19.下列有关离子方程式正确的是( )
| A. | 向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
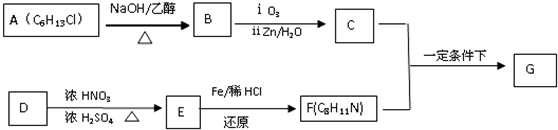
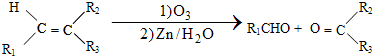
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$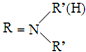 +H2O
+H2O +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O
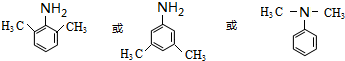 .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式).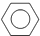 $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$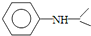
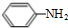 .
.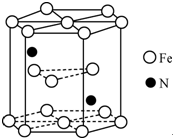 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. .
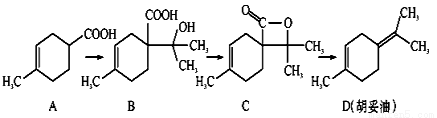
.
 .
.