��Ŀ����
����Ŀ��������������һ�ְ�ɫ��ĩ������ˮ�γɵ���Һ�������ԡ����������ز��ȶ����ں����ؽ������ӵȻ��Դ����Ĵ�����Ѹ�ٷֽ⡣��ҵ�������������ص�ԭ�����������¡�
![]()

�ش��������⣺
��1����֪�����������е�CO(NH2)2��H2O2��������ӣ�����̼Ԫ�صĻ��ϼ���______��������ţ�
A��+2�� B��-1�� C��0�� D��+4��
��2�����������ؼ�����Ӧ�����ظ����������Һ�м������Ѻ��������������أ����ϲ����ѳ���ɫ������������������Һ�й����������еĹ����������ظ���ط�Ӧ���ɽ��ȶ�����ɫ����������CrO5�������������ɡ�д��H2O2���ظ���ط�Ӧ�����˷���ʽ____��
��3������������ѧ���պ�IJ�Ʒ�Ǵֲ�Ʒ����֪30��ʱ���ص��ܽ��Զ���ڹ��������ص��ܽ�ȣ����ᴿ�ֲ�Ʒ�IJ���˳����___������ţ���
����ȴ��30��ᾧ �ڹ��� ������Ũ�� ���ܽ� ��ϴ��
��4����ʵ�����в�������ԭ����ȡ���������أ��������IJ���һ���ò����������ʣ�ԭ����___��
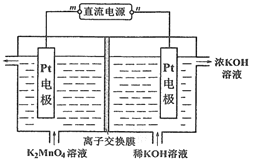
��5��������صļ�����Һ�����װ��ʾ��ͼ��ͼ�������и�Ĥ����ֹ����ͨ��������������Ϊ���Ե缫�������ʱ�������ĵ缫��ӦʽΪ_________��

��6����Ϊ�ⶨ��Ʒ��H2O2�ĺ���������KMnO4��Һ�ζ�H2O2��������ر���Һͨ������ʱ��ϳ�������ڵζ�H2O2ǰ����������IJ�������Һ�ȱ궨��KMnO4����Һ��Ũ�ȡ�
��ȡ������������Ʒ4.00g ���ܽ���250mL����ƿ�ж��ݡ�ȷ��ȡ25.00mL����ƿ�м���1.00mL 6mo1/L�����ᣬ�ñ궨����0.2000mol/L�ĸ�����ر���Һ�ζ����������һ��ʱ��Һ��dz��ɫ�Ұ�����ڲ���ɫ�����εζ�ƽ������KMnO4����Һ10.00mL��KMnO4�����ز���Ӧ����
��H2O2������������_____����ȷ��0.1%)��
����װ��������Һ�ĵζ���ˮϴ��δ��ϴ������H2O2����������__������ƫ��������ƫС������������)

���𰸡�D 4H2O2+Cr2O72-+2H+=2CrO5+5H2O �ܢۢ٢ڢ� ��H2O2ˮ��Һ�������ԣ���H2O2���������ʷ�Ӧ���ڽ����������ɿɴ�H2O2�ֽ��Fe3+ CO(NH2)2+8OH--6e-=CO32-+N2��+6H2O 42.5% ƫ��
��������
��1�����ݻ�����Ļ��ϼ۴�����Ϊ0���������Ԫ�س������ϼ����̼Ԫ�ػ��ϼۣ�
��2����������Һ�й����������еĹ����������ظ���ط�Ӧ���ɽ��ȶ�����ɫ����������CrO5����CrԪ�ػ��ϼ����ߣ������������������������������ԭ��Ӧ������д�����ӷ���ʽ��
��3�������֪��Ϣ�����������ᾧ�ķ����ᴿ�ֲ�Ʒ��
��4������������������ʷ���������ԭ��Ӧ���������ӿ���Ϊ��������ֽ�Ĵ������ӿ���ֽ⣻
��5����������ʧ���ӷ���������Ӧ���ɵ�������ϵ��ԭ����������
��6�����ݸ��������������ⷴӦ�Ĺ�ϵʽ���ҳ��������������������ʵ���֮��Ĺ�ϵ���������H2O2���������������ݲ������������Ը���������������Ӱ�켰��ϵʽ�ó����ۡ�
��l��CO��NH2��2H2O2��������ӵ�Ϊ���Ӽ�����������Ԫ��Ϊ+1�ۣ���Ԫ�ػ��ϼ�Ϊ-2�ۣ���Ԫ�ػ��ϼ�-3�ۣ�����õ�̼Ԫ�ػ��ϼ�Ϊ+4�ۣ�D����ȷ��
�ʴ�Ϊ��D��
��2����������Һ�й����������еĹ����������ظ���ط�Ӧ���ɽ��ȶ�����ɫ����������CrO5����H2O2���ظ���ط�Ӧ�����ӷ���ʽΪ��4H2O2+Cr2O72-+H+=2CrO5+5H2O��
�ʴ�Ϊ��4H2O2+Cr2O72-+2H+=2CrO5+5H2O��
��3������������ѧ���պ�IJ�Ʒ�Ǵֲ�Ʒ����֪30��ʱ���ص��ܽ��Զ���ڹ��������ص��ܽ�ȣ����ᴿ�ֲ�Ʒ�ɲ������ܽ�������Ũ������ȴ�ᾧ��������ϴ�ӡ�����õ����壬����˳���Ǣܢۢ٢ڢݣ�
�ʴ�Ϊ���ܢۢ٢ڢݣ�
��4����ʵ�����в�������ԭ����ȡ���������أ��������IJ���һ���ò����������ʣ�ԭ����H2O2ˮ��Һ�������ԣ���H2O2���������ʷ�Ӧ�������������ɿɴ�H2O2�ֽ��Fe3+���ʴ�Ϊ����H2O2ˮ��Һ�������ԣ���H2O2���������ʷ�Ӧ���ڽ����������ɿɴ�H2O2�ֽ��Fe3+��
��5����ͼ��֪��CO��NH2��2�������ŵ�����N2��CԪ�ؼ�̬δ�仯���ʻ���̼�����ˮ���ɣ��缫��ӦʽΪCO��NH2��2+8OH--6e-=CO32-+N2��+6H2O��
�ʴ�Ϊ��CO��NH2��2+8OH--6e-=CO32-+N2��+6H2O��
��6��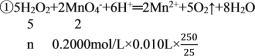
��������������ʵ���n=0.05mol����������������������=![]() ��100% = 42.5%��
��100% = 42.5%��
�ʴ�Ϊ��42.5%��
����װ��������Һ�ĵζ���ˮϴ��δ��ϴ�����ı궨��Һ��������������ҺŨ��ƫС����ζ�ʵ�������ı���Һ������ⶨ���������
�ʴ�Ϊ��ƫ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��t��ʱ����3 mol A��2 mol B����ͨ�����Ϊ2L���ܱ������У��ݻ����䣩���������·�Ӧ��3A(g)+B(g) ![]() 2C(g)��2 minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩�����C��Ũ��Ϊ0.2 mol/L������д���пհף�
2C(g)��2 minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩�����C��Ũ��Ϊ0.2 mol/L������д���пհף�
��1���ù�����A��ʾ�ķ�Ӧ����Ϊ��v(A)=_______�����¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ__________��
��2���Ƚϴﵽƽ��ʱ��A��B����Ӧ���ת���ʣ���(A)______��(B)�����������=����������
��3���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ�__________��
a������C������������B��������� b�����������ܶȲ���
c�������������ƽ�������������� d��A�������������ٷ����仯
��4���������¶ȣ��ٴδ�ƽ��ʱ��ƽ�ⳣ����ֵ�����÷�Ӧ��![]() H_____0�����������=����������
H_____0�����������=����������
��5���������¶Ȳ���ʱ��������ԭƽ�������������ͨ����������(������A��B��C������Ӧ)����ѧ��Ӧ���ʻ�__________����ӿ족�������������䡱������ѧƽ�⽫_________�������Ӧ�����ƶ��������淴Ӧ�����ƶ������ƶ�������
��6���ں��º����ܱ������н���������Ӧ����ʼͶ��ʱ�����ʵ�Ũ�����±���
A | B | C | |
Ͷ��I | 3.0 mol/L | 1.0 mol/L | 0 |
Ͷ��II | 2.0 mol/L | 1.0 mol/L | 2.0 mol/L |
��Ͷ��I���з�Ӧ����ôﵽ��ѧƽ��״̬ʱA��ת����Ϊ40��������Ͷ��II���з�Ӧ����ʼʱ��Ӧ���еķ���Ϊ________��������������ƶ�����