题目内容
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) + 1/2 O2(g)![]() CO(g) + 2H2(g)
CO(g) + 2H2(g) ![]() H1 =-35.4kJ·mol-1 平衡常数K1
H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g)
CH3OH (g) ![]() H2 =-90.1 kJ·mol-1 平衡常数K2
H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g) ![]() H3 平衡常数K3
H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g) ![]() H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(![]() H)决定
H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:
H2(g)+I2(g) === 2HI(g) ![]() H3 = -14.9 kJ·mol-1
H3 = -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
(4)甲醇燃料电池的种类很多,我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液。该电池负极的电极反应式为_____________________________。
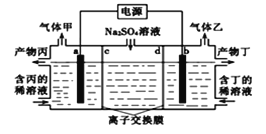
如图是自呼吸式甲醇燃料电池工作示意图。图中进入c口的物质可能是______________,若有16g甲醇参与原电池反应,理论上电池内部有___________mol 质子通过质子交换膜。

【答案】CH3OH(l)+3/2O2(g)=CO 2(g)+2H2O(l) ΔH=-725.76kJ·mol-1 -251 K12·K22 b d e CH3OH-6e-+8OH-==CO32-+6H2O O2或空气 3mol
【解析】
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68kJ×32=725.8kJ,依据热化学方程式的书写方法和注意问题,标注对应反应的焓变写出;
(2)根据盖斯定律进行求算;
(3)结合化学反应中的能量及变化理解;
(4)甲醇燃料电池负极为甲醇失电子,正极为氧气得电子。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成液态水和二氧化碳气体放热22.68kJ×32=725.8kJ,反应的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(2)已知① CH4(g) + ![]() O2(g)
O2(g)![]() CO(g) + 2H2(g)
CO(g) + 2H2(g) ![]() H1 =-35.4kJ·mol-1
H1 =-35.4kJ·mol-1
② CO(g) + 2H2(g) ![]() CH3OH (g)
CH3OH (g) ![]() H2 =-90.1 kJ·mol-1
H2 =-90.1 kJ·mol-1
根据盖斯定律,由①![]() +②
+②![]() 得反应③ 2CH4(g) + O2(g)
得反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g) ![]() H3=(
H3=(![]() H1 +
H1 +![]() H2)
H2) ![]() =(-35.4kJ·mol-1-90.1 kJ·mol-1)
=(-35.4kJ·mol-1-90.1 kJ·mol-1) ![]() =-251 kJ·mol-1;
=-251 kJ·mol-1;
K3= K12·K22;
(2)a、活化能的作用在于使反应物活化,从而启动反应或改变反应速率,故a正确;
b.成键释放能量,但不一定发生氧化还原反应,则化学键的形成一定伴随着能量变化,不一定存在电子的转移,故b错误;
c.反应放热或吸热的能量变化是有反应物和生成物的焓值差决定,即焓变决定反应热量变化,故c正确;
d.化学反应是实质是有旧化学键的断裂和新化学键的形成,离子键被破坏的变化不一定发生化学变化,氯化钠晶体熔化时,离子键被破坏,吸收能量,无化学键形成,未发生化学变化,故d错误;
e.在200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应是可逆反应,放出14.9kJ的热量,则热化学方程式可表示为:H2(g)+I2(g) ![]() 2HI(g)△H<-14.9kJ/mol,故e错误;
2HI(g)△H<-14.9kJ/mol,故e错误;
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了,如碳生成二氧化碳,故f正确;
答案选bde;
(4)碱性条件下甲醇在电池负极失去电子产生碳酸根离子,电极反应式为CH3OH-6e-+8OH-==CO32-+6H2O;
如图是自呼吸式甲醇燃料电池工作示意图。原电池中阳离子氢离子定向移动到正极,图中进入c口的物质可能是氧气或空气;
根据电极反应式为CH3OH-6e-+OH-==CO32-+6H2O,若有16g甲醇(0.5mol)参与原电池反应,理论上电池内部有3mol 质子通过质子交换膜。

 同步奥数系列答案
同步奥数系列答案