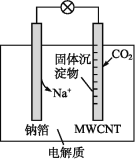
题目内容
【题目】向50mLNaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
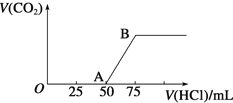
A. OA段所发生反应的离子方程式:H+ + OH-= H2O
B. 产生的CO2体积(标准状况下)为0.056L
C. 原NaOH溶液的物质的量浓度为0.75mol·L-1
D. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
【答案】A
【解析】
NaOH与CO2反应,反应后溶液中溶质可能为NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3,与盐酸反应先后:NaOH、Na2CO3、NaHCO3,抓住Na2CO3与盐酸反应的实质;
NaOH与CO2反应,反应后溶液中溶质可能为NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3,与盐酸反应先后:NaOH、Na2CO3、NaHCO3,发生反应:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,根据图像,OA段消耗盐酸的体积大于AB段,推出NaOH与HCl反应后溶液中的溶质为NaOH和Na2CO3,
A、根据上述分析,OA段发生离子反应是OH-+H+=H2O、CO32-+H+=HCO3-,故A说法错误;
B、AB段发生反应HCO3-+H+=H2O+CO2↑,n(CO2)=(75-50)×10-3L×0.1mol·L-1=2.5×10-3mol,标准状况下CO2的体积为2.5×10-3L×22.4L·mol-1=0.056L,故B说法正确;
C、B点溶质为NaCl,根据元素守恒,n(NaOH)=n(NaCl)=n(HCl)=75×10-3L×0.1mol·L-1=7.5×10-3mol,其浓度为7.5×10-3mol/10×10-3mL=0.75mol·L-1,原溶液中NaOH浓度为0.75mol·L-1,故C说法正确;
D、根据A、B选项分析,n(Na2CO3)=n(NaHCO3)=n(CO2)=2.5×10-3mol,依据A选项分析,n(NaOH)=[50-(75-50)]×10-3L×0.1mol·L-1=2.5×10-3mol,物质的量之比等于物质的量浓度之比,即c(NaOH):c(Na2CO3)=1:1,故D说法正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验能达到相应实验目的的是
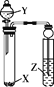
选 项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z | |||
A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |
|
B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
C | Na2CO3 | 醋酸 | Na2SiO3溶液 | 证明酸性: CH3COOH > H2CO3 >H2SiO3 | |
D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
A. AB. BC. CD. D