题目内容
【题目】科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)
1918年,德国化学家哈伯因发明工业合成氨的方法而荣获诺贝尔化学奖。
(1)若将1 mol N2和3 mol H2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为________mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是________________。
a. υ(N2)正=3υ(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)若1 mol N2完全转化为NH3的反应热为![]() H=-92 kJ/mol,拆开1 mol H—H键和1 mol N
H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)
1998年,两位希腊化学家提出了电解合成氨的新思路:
采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
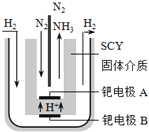
钯电极A是电解池的________极(填“阳”或“阴”),阳极反应式为__________________。
(方法三)
最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H=-92 kJ/mol
H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) ![]() H=-571.6 kJ/mol
H=-571.6 kJ/mol
写出上述固氮反应的热化学方程式________________________________。
【答案】0.04 c d 391 C 阴 H2-2e-=2H+ 2N2(g)+6H2O(I)=4NH3(g)+3O2(g) ![]() H=+1530.8 kJ/mol
H=+1530.8 kJ/mol
【解析】
本题考查的是速率的计算、平衡标志、键能的计算、平衡移动、电极式书写、盖斯定律。
方法一:(1)将1 mol N2和3 mol H2放入1L的密闭容器中,则c(N2)= ![]() ,c(H2)=
,c(H2)= ![]() ,5min后N2的浓度为0.8mol/L,则
,5min后N2的浓度为0.8mol/L,则![]() ,则υ(N2)
,则υ(N2)![]() ;
;
(2)a.若用不同的物质表示反应速率,应一种物质用正反应速率表示,一种物质用逆反应速率表示,且速率之比等于化学计量数之比,则应3υ(N2)正=υ(H2)逆,可以证明反应达到平衡状态,故a错误;
b.ρ=m/V,气体质量和总体积都不随时间而变化,密度不随时间而变化不能证明反应达到平衡状态,故b错误;
c.氮气和氢气生成氨气的反应为反应前后气体总物质的量变化的反应,即反应前后气体的分子总数变化的反应,当气体的分子总数不变时,可以证明反应达到平衡状态,故c正确;
d.M=m/n,气体质量不变,气体总物质的量随时间而变化,当平均相对分子质量不变时,则可以证明反应达到平衡状态,故d正确;
(3)设拆开1mol N-H键需要的能量是x,由△H=反应物键能和-生成物键能和,得-92kJ=436kJ×3+946kJ-6x,解得:x=391kJ;
(4)①使用催化剂,不会引起化学平衡的移动,不能用勒夏特列原理解释,故①不符合题意。
②高温,不利于氨气的合成,但是可以提高催化剂的催化活性,不能用勒夏特列原理解释,故②不符合题意。
③增大压强,化学平衡会正向移动,有利于氨气的合成,能用勒夏特列原理解释,故④符合题意。
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中,都会使得化学平衡正向移动,有利于氨的合成,能用勒夏特列原理解释,故④符合题意;
方法二:根据图示信息,阳离子移向阴极,可知钯电极A是阴极,阳极发生失电子的氧化反应,即H2-2e-=2H+;
方法三:已知:①N2(g)+3H2(g)2NH3(g)△H=92kJmol1,
②2H2(g)+O2(g)═2H2O(l)△H=571.6kJmol1,
根据盖斯定律①×2②×3可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=(92kJmol1)×2(571.6kJmol1)×3=+1530.8kJmol1。据此解答。
方法一:(1)将1 mol N2和3 mol H2放入1L的密闭容器中,则c(N2)= ![]() ,c(H2)=
,c(H2)= ![]() ,5min后N2的浓度为0.8mol/L,则
,5min后N2的浓度为0.8mol/L,则![]() ,则υ(N2)
,则υ(N2)![]() ;本小题答案为:0.04。
;本小题答案为:0.04。
(2)a.若用不同的物质表示反应速率,应一种物质用正反应速率表示,一种物质用逆反应速率表示,且速率之比等于化学计量数之比,则应3υ(N2)正=υ(H2)逆,可以证明反应达到平衡状态,故a错误;
b.ρ=m/V,气体质量和总体积都不随时间而变化,密度不随时间而变化不能证明反应达到平衡状态,故b错误;
c.氮气和氢气生成氨气的反应为反应前后气体总物质的量变化的反应,即反应前后气体的分子总数变化的反应,当气体的分子总数不变时,可以证明反应达到平衡状态,故c正确;
d.M=m/n,气体质量不变,气体总物质的量随时间而变化,当平均相对分子质量不变时,则可以证明反应达到平衡状态,故d正确;故选:cd。
(3)设拆开1mol N-H键需要的能量是x,由△H=反应物键能和-生成物键能和,得-92kJ=436kJ×3+946kJ-6x,解得:x=391kJ;本小题答案为:391。
(4)①使用催化剂,不会引起化学平衡的移动,不能用勒夏特列原理解释,故①不符合题意。
②高温,不利于氨气的合成,但是可以提高催化剂的催化活性,不能用勒夏特列原理解释,故②不符合题意。
③增大压强,化学平衡会正向移动,有利于氨气的合成,能用勒夏特列原理解释,故④符合题意。
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合塔中,都会使得化学平衡正向移动,有利于氨的合成,能用勒夏特列原理解释,故④符合题意;答案选C。
方法二:根据图示信息,阳离子移向阴极,可知钯电极A是阴极,阳极发生失电子的氧化反应,即H2-2e-=2H+。故本小题答案为:阴;H2-2e-=2H+。
方法三:已知:①N2(g)+3H2(g)2NH3(g)△H=92kJmol1,
②2H2(g)+O2(g)═2H2O(l)△H=571.6kJmol1,
根据盖斯定律①×2②×3可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=(92kJmol1)×2(571.6kJmol1)×3=+1530.8kJmol1。本小题答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) ![]() H=+1530.8 kJ/mol。
H=+1530.8 kJ/mol。