题目内容
【题目】(1)氯原子核外有________种不同运动状态的电子;基态溴原子的价电子排布式为_______;比较氟、氯、溴单质熔点的高低并说明理由___________。
(2)HF极易溶于水的原因是______。
(3)已知高碘酸有两种形式,化学式分别为H5IO6(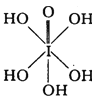 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(多选,填字母);
A.金属键B.离子键 C.极性键D.非极性键E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g·cm-3(用含a、NA的式子表示)。
【答案】17 4s24p5 溴>氯>氟(或氟<氯<溴);氟、氯、溴单质属于分子晶体,相对分子质量越大,分子间作用力越大,熔点越高 HF和H2O均为极性分子,根据相似相溶;HF与H2O分子之间能形成氢键 < V形 sp3杂化 BCD ![]()
【解析】
(1)氯是17号元素,基态氯原子核外有17种不同运动状态的电子;溴为35号元素,最外层电子数为7,基态溴原子的价电子排布式为4s24p5;氟、氯、溴单质属于分子晶体,相对分子质量越大,分子间作用力越大,熔点越高,故氟、氯、溴单质熔点的高低顺序为溴>氯>氟(或氟<氯<溴);(2)HF和H2O均为极性分子,根据相似相溶;HF与H2O分子之间能形成氢键,故HF极易溶于水;(3)H5IO6(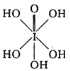 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4;(4)I3+中心原子的价层电子对数为
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4;(4)I3+中心原子的价层电子对数为![]() =4,则为sp3杂化,价层电子对为正四面体,中心I原子的孤电子对数为
=4,则为sp3杂化,价层电子对为正四面体,中心I原子的孤电子对数为![]() =2,为V形;(6)根据晶体的结构可知,[LiC60]PF6晶体中,[LiC60]+与PF6-之间是离子键,PF6-内部存在极性共价键,([LiC60]+表示1个Li+位于1个C60内部,碳碳之间有非极性共价键,故选BCD;根据氯化钠晶胞知,该晶胞中([LiC60]+、PF6-个数都是4,边长anm=a×10-7cm,体积为(a×10-7)3cm3,密度ρ=
=2,为V形;(6)根据晶体的结构可知,[LiC60]PF6晶体中,[LiC60]+与PF6-之间是离子键,PF6-内部存在极性共价键,([LiC60]+表示1个Li+位于1个C60内部,碳碳之间有非极性共价键,故选BCD;根据氯化钠晶胞知,该晶胞中([LiC60]+、PF6-个数都是4,边长anm=a×10-7cm,体积为(a×10-7)3cm3,密度ρ=![]() =
=![]() =
=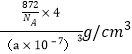 =
=![]() 。
。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案