题目内容
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
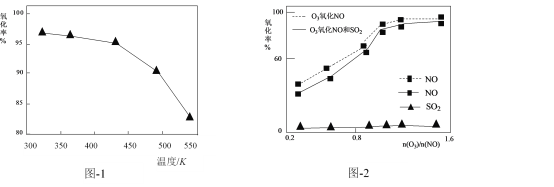
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
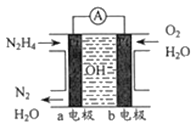
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。
【答案】![]() O3在较高温度下易分解 NaNO3 SO2的氧化消耗了少量O3,减小了O3的浓度 a b 2CO(NH2)2+ 6NO
O3在较高温度下易分解 NaNO3 SO2的氧化消耗了少量O3,减小了O3的浓度 a b 2CO(NH2)2+ 6NO![]() 5N2+2CO2+4H2O CO(NH2)2 - 6e- + 8OH- = CO32-+ N2↑+ 6H2O
5N2+2CO2+4H2O CO(NH2)2 - 6e- + 8OH- = CO32-+ N2↑+ 6H2O
【解析】
根据盖斯定律可将热化学方程式进行加减运算。解释实验结果,必须先清楚实验现象(图象数据关系),再用化学原理分析可能原因。
(1)将三个已知热化学方程式自上而下编号为①②③,(1)中所求热化学方程式编号为④。消去无关物质,保留有关物质,得④=③×![]() +②-①×
+②-①×![]() ,得ΔH=ΔH3×
,得ΔH=ΔH3×![]() +ΔH2-ΔH1×
+ΔH2-ΔH1×![]() =
=![]() 。
。
(2)O3氧化NO的反应为NO +O3=NO2 +O2 。温度升高,O3分解为O2,使NO的氧化率下降。 NO2、NO3组成的混合物相当于N2O5(物质的量之比1:1时),N2O5是酸性氧化物,用NaOH溶液吸收时生成盐的化学式为NaNO3。
(3)图-2表明相同条件下,有SO2时NO的氧化率略低于无SO2时NO的氧化率。可能是共存的SO2消耗了少量O3,使与NO反应的O3略有减少。
脱硝反应为NO +O3=NO2 +O2,脱硫反应为SO2 +O3=SO3 +O2。图-2表明相同条件下,脱硝反应中NO氧化率较高,脱硫反应中SO2氧化率很低。可能是脱硝反应活化能小、反应快,脱硫反应活化能大、反应慢。能解释该结果的是a b 。
(4)由反应物的组成元素,可判断生成的三种无毒气体是N2、CO2、H2O,进而写出化学方程式 2CO(NH2)2+ 6NO![]() 5N2+2CO2+4H2O。该反应设计成碱性燃料电池时,负极CO(NH2)2失电子,负极反应为CO(NH2)2 - 6e- + 8OH- = CO32- + N2↑ + 6H2O;正极NO得电子,正极反应为2NO+4e-+ 2H2O=N2↑ + 4OH-。
5N2+2CO2+4H2O。该反应设计成碱性燃料电池时,负极CO(NH2)2失电子,负极反应为CO(NH2)2 - 6e- + 8OH- = CO32- + N2↑ + 6H2O;正极NO得电子,正极反应为2NO+4e-+ 2H2O=N2↑ + 4OH-。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案