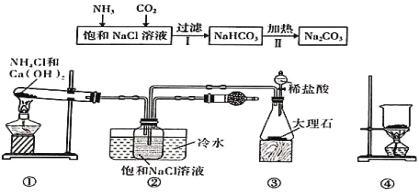
题目内容
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,原子序数依次增大。已知 A 的气态氢化物能与其最高价氧化物对应的水化物反应得到一种离子化合物,B 的一种单质具有杀菌消毒的作用,C+和 D3+的电子层结构相同,E 的主族序数是其周期序数的2倍。
(1)F 在元素周期表中的位置是__________________。
(2)上述元素形成的简单离子中,半径最大的是__________________ (填离子符号)
(3)由上述元素中的一种或几种组成的物质甲可以发生如图反应:
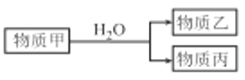
①若丙具有漂白性,则甲和水反应的离子方程式为_________________。
②若乙的水溶液是强碱性溶液,物质丙为B 的一种单质,则甲中含有的化学键类型为_______________,D 的单质与乙的水溶液反应的离子方程式为______________。
(4)A 的最高价氧化物对应的水化物的稀溶液与金属铜反应的离子方程式为_____________________________。
【答案】第三周期第VIIA 族 S2- C12 +H2O =H+ +C1- +HC1O 离子键、(非极性)共价键 2Al+2OH- +2H2O=2A1O2- +3H2 ↑ 3Cu+8H+ +2NO3- = 3Cu2+ +2NO ↑+4H2O
【解析】
A、B、C、D、E、F 六种短周期主族元素,原子序数依次增大。已知 A 的气态氢化物能与其最高价氧化物对应的水化物反应得到一种离子化合物,则A为氮(N);B 的一种单质具有杀菌消毒的作用,则B为氧(O);C+和 D3+的电子层结构相同,则C为钠(Na),D为铝(Al);E 为第三周期元素,其主族序数是其周期序数的2倍,则E为硫(S),F为氯(Cl)。
(1)F 为氯(Cl),在元素周期表中的位置是第三周期第VIIA 族。答案为:第三周期第VIIA 族;
(2)上述元素形成的简单离子中,半径最大的是电子层数多、核电荷数小的非金属离子,因为离子半径S2->Cl-,所以应为S2-。答案为:S2-;
(3)①若丙具有漂白性,则应为HClO,甲为Cl2,Cl2和水反应的离子方程式为C12 +H2O =H+ +C1- +HC1O。答案为:C12 +H2O =H+ +C1- +HC1O;
②若乙的水溶液是强碱性溶液,则其为NaOH,物质丙为B 的一种单质,则应为O2,甲为Na2O2,含有的化学键类型为离子键、(非极性)共价键;D 的单质为Al,与乙(NaOH)的水溶液反应,生成NaAlO2和H2,离子方程式为2Al+2OH- +2H2O=2A1O2- +3H2 ↑。答案为:离子键、(非极性)共价键;2Al+2OH- +2H2O=2A1O2- +3H2 ↑;
(4)A 的最高价氧化物对应的水化物为HNO3,它的稀溶液与金属铜反应,生成Cu(NO3)2、NO和H2O,离子方程式为3Cu+8H+ +2NO3- = 3Cu2+ +2NO ↑+4H2O。答案为:3Cu+8H+ +2NO3- = 3Cu2+ +2NO ↑+4H2O。

【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。