题目内容
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
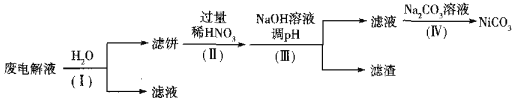
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
【答案】![]() +3 NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F 阳 H2 除去NH4HF2 3Ni+8H++2NO3-=3Ni2++2NO+4H2O 6.7≤pH<7.2
+3 NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F 阳 H2 除去NH4HF2 3Ni+8H++2NO3-=3Ni2++2NO+4H2O 6.7≤pH<7.2
【解析】
(1)NF3为共价化合物,电子式为![]() ,N为+3价、F为-1价,
,N为+3价、F为-1价,
故答案为:![]() ;+3;
;+3;
(2)F2与NH3直接反应生成NF3,同时生成HF或NH4F,方程式为NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F,
故答案为:NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F;
(3)①利用电解熔融NH4HF2(NH4FHF)法制取NF3,N元素被氧化,应为阳极反应;阴极生成氢气,
故答案为:阳;H2;
②由流程可知,加水溶解,可除去NH4HF2,加入过量稀硝酸,金属溶解,Ni溶于硝酸的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO+4H2O,调节溶液pH,使铜离子、铁离子完全沉淀,且避免镍离子沉淀,则调节pH的范围为6.7≤pH<7.2,
故答案为:除去NH4HF2;3Ni+8H++2NO3-=3Ni2++2NO+4H2O;6.7≤pH<7.2。

【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | ||||||||
1 | ① | ⅡA | …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ||||||||
(1)②元素简单氢化物的电子式是________________________。
(2)③、④、⑤、⑦元素的离子半径由大到小的顺序为______________。
(3)⑥元素的名称为_______________,举出⑥单质的一个应用____________。
(4)上述所有元素中最高价氧化物对应的水化物的酸性最强的是_____________, 写出一个能证明⑧比⑦非金属性强的一个离子反应方程式___________________。
(5)有两种化合物A和B都由①③④⑦四种元素组成。若A与B在水溶液中能发生离子反应,则该反应的离子方程式为____________。
(6)⑨与④的原子序数之差为________。