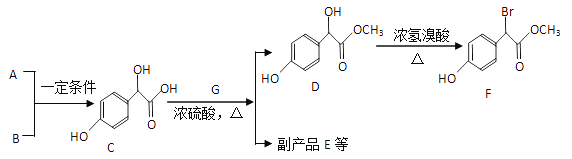
题目内容
【题目】焦亚硫酸钠(Na2S2O5)有广泛的用途,实验室中通过如下方法制备:
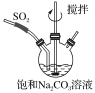
①不断搅拌条件下,在饱和Na2CO3溶液中缓缓通入SO2至反应完全;
②取下三颈烧瓶,测得反应液的pH=4.1;
③将溶液蒸发浓缩、结晶、过滤得焦亚硫酸钠晶体
请回答下列问题:
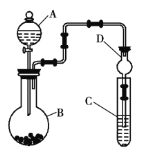
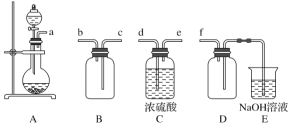
(1)实验室可利用Na2SO3和浓的硫酸制备少量SO2气体,但硫酸浓度太大不利于SO2气体逸出,原因是________。制备、收集干燥的SO2气体时,所需仪器如下。装置A是气体发生装置,按气流方向连接各仪器口,顺序为a→_____→______→______→________→f。装置D的作用是___________。
(2)步骤①反应的离子方程式为________________。
(3)在强碱性条件下利用Na2S2O5氧化HCOONa的方法可制备保险粉连二亚硫酸钠(Na2S2O4),当生成0.5molNa2S2O4时,消耗Na2S2O5______mol。
(4)工业上用焦亚硫酸钠法制备保险粉带来的主要问题是废水中含有大量的有机物,有机物总含碳量用TOC表示,常采用Fenton氧化法去除废水中的有机物,即通过向废水中加入H2O2,以Fe2+作催化剂,产生具有强氧化性的羟基自由基(·OH)来氧化降解废水中的有机物。
①其他条件一定时,n(H2O2)∶n(Fe2+)的值对TOC去除效果的影响如图1所示:
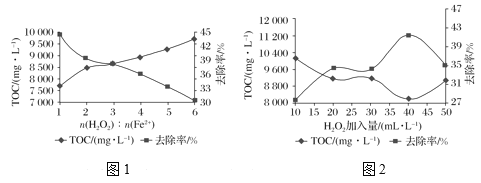
当TOC的去除率最大时,n(H2O2)∶n(Fe2+)=________。
②在pH=4.5,其他条件一定时,H2O2的加入量对TOC去除效果的影响如图2所示,当H2O2的加入量大于40mL·L1时,TOC去除率反而减小的原因是_____________。
【答案】浓硫酸中只有少量H2SO4电离,c(H+)很小,导致复分解反应速率慢 d e c b 防止倒吸 CO32-+2SO2+H2O=2HSO3-+CO2 0.5 1 酸性条件下H2O2直接与Fe2+反应,导致溶液中羟基自由基(·OH)浓度减小,使得TOC去除率下降
【解析】
(1)实验室选用浓硫酸的浓度太大,反应慢;连接仪器时,先明确装置的作用,再考虑接口的顺序;
(2)明确反应物为SO2和Na2CO3,生成物是NaHSO3;
(3)不必写出完整的化学方程式,直接依据硫原子守恒和化学式进行分析;
(4)“看图说话”,明确坐标系横坐标为1的点对应的数值即可;去除率减小肯定是强氧化性的羟基自由基少了;
(1)实验室用Na2SO3固体和浓硫酸制备少量SO2气体时,若硫酸的浓度太大,则溶液中c(H+)的浓度较小,导致该复分解反应的速率较慢。若硫酸浓度太小,则由于SO2气体易溶于水,也不利于SO2气体的逸出。收集SO2前应先干燥,所以a先接d,然后e接c进行向上排空气法收集(长管进,短管出)。装置D是一个安全瓶,起到防倒吸的作用。
(2)从反应液的pH=4.1可知生成的产物是NaHSO3而不是Na2SO3,起始原料是SO2和Na2CO3,所以步骤①的离子方程式为:2SO2+CO32-+H2O=2HSO3-+CO2;
(3)据硫原子守恒和Na2S2O5、Na2S2O4的化学式可知,Na2S2O5消耗量是0.5mol;
(4)①当TOC去除率最高时,TOC的含量最低,由图1横坐标可知此时n(H2O2):n(Fe2+)=1;
②当H2O2的加入量大于40mg·L-1时,随着H2O2含量增加去除率反而降低,说明H2O2必发生了其他副反应,比如酸性条件下H2O2与催化剂Fe2+直接发生了反应,从而减少了强氧化性的羟基自由基的浓度,使得TOC去除率下降。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案