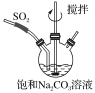
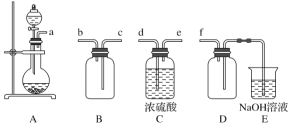
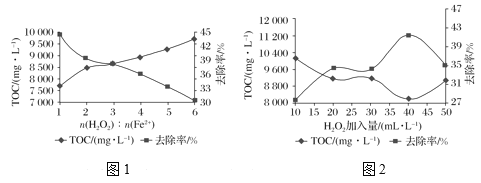
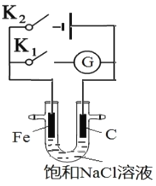
题目内容
【题目】将一定量的铜粉加入到100 mL某浓度的稀硝酸中充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体224 mL(标准状况),然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2 g, 则(m1-m2)为
A.5.76B.2.88C.1.92D.0.28
【答案】B
【解析】
铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1 g铜粉,反应生成Cu(NO3)2和NO气体,NO的物质的量为n(NO)=0.224L÷22.4L/mol=0.01mol,根据电子转移守恒可知,参加反应的铜的物质的量为0.01mol×(52)÷2=0.015mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=0.015mol,溶液中n(![]() )=0.03mol。再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中
)=0.03mol。再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中![]() 发生反应3Cu+8H++2
发生反应3Cu+8H++2![]() =3Cu2++2NO↑+4H2O,容器剩有铜粉m2 g,(m1-m2)为再与溶液中
=3Cu2++2NO↑+4H2O,容器剩有铜粉m2 g,(m1-m2)为再与溶液中![]() 反应的铜的质量,则由反应3Cu+8H++2
反应的铜的质量,则由反应3Cu+8H++2![]() =3Cu2++2NO↑+4H2O可知0.03mol
=3Cu2++2NO↑+4H2O可知0.03mol ![]() 再发生反应消耗Cu的物质的量是n(Cu)=
再发生反应消耗Cu的物质的量是n(Cu)=![]() ×n(
×n(![]() )=
)=![]() ×0.03mol=0.045mol,所以再次反应的铜的质量为0.045mol×64g/mol=2.88g,即(m1-m2)=2.88g,故B正确,选择B。
×0.03mol=0.045mol,所以再次反应的铜的质量为0.045mol×64g/mol=2.88g,即(m1-m2)=2.88g,故B正确,选择B。

练习册系列答案
相关题目