题目内容
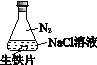
【题目】如图,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实相符的是

A.若a为Cl2,b为滴有酚酞的NaOH溶液,可出现红色喷泉
B.若a为CO2,b为NaHCO3溶液,可出现无色喷泉
C.若a为HCl,b为AgNO3溶液,可出现白色喷泉
D.若a为NH3,b为水(预先滴加少量石蕊溶液),可出现红色喷泉
【答案】C
【解析】
干燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛放同一种溶液,挤压胶头滴管,如能形成喷泉,说明气体能易溶于溶液或与溶液反应,导致烧瓶内压强减小而形成喷泉,据此分析。
A.因氢氧化钠溶液能吸收Cl2,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉;又因氢氧化钠溶液呈碱性,滴有酚酞的NaOH溶液呈红色,Cl2与NaOH反应碱性减弱,且生成的NaClO有强氧化性,具有漂白性,最后溶液为无色,A错误;
B.CO2不溶于NaHCO3溶液,则挤压胶管的胶头,气压变化不明显,则不会形成喷泉,B错误;
C.因HCl与AgNO3溶液反应生成白色的AgCl沉淀,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因溶液中有白色的AgCl,溶液变白,故形成白色喷泉,C正确;
D.因氨气极易溶于水,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因氨水溶液显碱性,石蕊遇碱变蓝色,故形成蓝色喷泉,D错误;
答案选C。

【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2