题目内容
25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A、将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| B、pH均为9的三种溶液:CH3COOH、Na2CO3、NaOH,其物质的量浓度的大小顺序是NaOH 溶液>CH3COOH溶液>Na2CO3溶液 |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
| D、0.2mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合:c(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.二者混合后溶液中的溶质是等物质的量浓度的HA和NaA,溶液呈碱性,说明酸根离子水解程度大于HA电离程度,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
B.pH相等的CH3COOH、Na2CO3、NaOH,强碱的物质的量浓度最小,酸根离子水解程度越大,则盐的浓度越小;
C.混合液的pH等于7,则c(H+)=c(OH-),再根据电荷守恒判断;
D.混合溶液中存在等物质的量浓度的 NaHCO3和 Na2CO3,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
B.pH相等的CH3COOH、Na2CO3、NaOH,强碱的物质的量浓度最小,酸根离子水解程度越大,则盐的浓度越小;
C.混合液的pH等于7,则c(H+)=c(OH-),再根据电荷守恒判断;
D.混合溶液中存在等物质的量浓度的 NaHCO3和 Na2CO3,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答:
解:A.二者混合后溶液中的溶质是等物质的量浓度的HA和NaA,溶液呈碱性,说明酸根离子水解程度大于HA电离程度,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得2c(Na+)=c(A-)+c(HA),所以得2c(OH-)+c(A-)=2c(H+)+c(HA),故A正确;
B.pH相等的CH3COOH、Na2CO3、NaOH,强碱的物质的量浓度最小,酸根离子水解程度越大,则盐的浓度越小,水解程度:CO32->CH3COO-,所以浓度大小顺序是:CH3COOH溶液>Na2CO3溶液>NaOH 溶液,故B错误;
C.混合液的pH等于7,则c(H+)=c(OH-),根据电荷守恒得2c(R2-)+c(HR-)=c(Na+),故C错误;
D.混合溶液中存在等物质的量浓度的 NaHCO3和 Na2CO3,溶液中存在电荷守恒和物料守恒,物料守恒式为2c(Na+)=3c(HCO3-)+3c(H2CO3)+3c(CO32-),根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),所以得c(HCO3-)+3c(H2CO3)+2c(H+)=2c(OH-)+c(CO32-),故D错误;
故选A.
B.pH相等的CH3COOH、Na2CO3、NaOH,强碱的物质的量浓度最小,酸根离子水解程度越大,则盐的浓度越小,水解程度:CO32->CH3COO-,所以浓度大小顺序是:CH3COOH溶液>Na2CO3溶液>NaOH 溶液,故B错误;
C.混合液的pH等于7,则c(H+)=c(OH-),根据电荷守恒得2c(R2-)+c(HR-)=c(Na+),故C错误;
D.混合溶液中存在等物质的量浓度的 NaHCO3和 Na2CO3,溶液中存在电荷守恒和物料守恒,物料守恒式为2c(Na+)=3c(HCO3-)+3c(H2CO3)+3c(CO32-),根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),所以得c(HCO3-)+3c(H2CO3)+2c(H+)=2c(OH-)+c(CO32-),故D错误;
故选A.
点评:本题考查了离子浓度大小比较,根据溶液中的溶质及其性质再结合守恒思想分析解答,注意B中酸的强弱与酸根离子水解程度关系,注意D中通过电荷守恒和物料守恒得到的式子,这些都是易错点.

练习册系列答案
相关题目
向纯水中加入少量的KHSO4固体(温度不变),则溶液的( )
| A、pH值升高 |
| B、c(H+)和c(OH-)的乘积增大 |
| C、酸性增强 |
| D、OH-离子浓度增大 |
下列化学用语表示正确的是( )
| A、高氯酸的化学式:HClO3 |
B、氮气的电子式: |
C、氟原子结构示意图: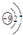 |
| D、乙烯的结构简式:CH2CH2 |
下列叙述不正确的是( )
| A、金属X能与NaOH溶液反应放出H2,但金属Y不能,则Y的金属性一定比X弱 |
| B、在合成氨反应达到平衡时,只增加N2的物质的量,达新平衡后N2的百分含量增大 |
| C、在铁件上镀铜时,铁和电源负极相连,铜和正极相连,电解质溶液是CuSO4溶液 |
| D、Cl2和SO2等体积充分混合后,通入品红溶液,溶液颜色没有明显变化 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温下,18g H2O中含H2数目为NA |
| B、标准状况下,22.4L H2O中含有化学键的数目为2NA |
| C、将0.5mol SO2通入足量水中,充分反应后可得到H2 SO3分子数为0.5NA |
| D、常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
欧盟正考虑在欧盟范围内全面禁止使用塑料袋.下列有关说法正确的是( )
| A、塑料垃圾可直接露天焚烧 |
| B、实施“禁塑令”有助于遏制白色污染 |
| C、纤维素、油脂、蛋白质均属于有机高分子 |
D、聚丙烯结构式为: |
下列指定物质的个数比不为1:1的是( )
| A、D2O中质子数与中子数 |
| B、Na2O2中的阴,阳离子数 |
| C、SO2与氯水反应生成两种强酸的反应中,氧化剂与还原剂 |
| D、沸水时纯水中H+与OH- |
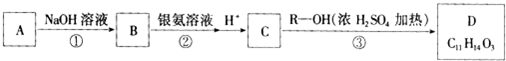 C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为 ,其中R、R′为烃基.请回答以下问题:
,其中R、R′为烃基.请回答以下问题: ,且属于酯的所有同分异构体的结构简式
,且属于酯的所有同分异构体的结构简式