题目内容
向纯水中加入少量的KHSO4固体(温度不变),则溶液的( )
| A、pH值升高 |
| B、c(H+)和c(OH-)的乘积增大 |
| C、酸性增强 |
| D、OH-离子浓度增大 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:水是弱电解质,存在电离平衡:H2O?H++OH-,加入硫酸氢钾溶液后,溶液中氢离子浓度增大,抑制了水的电离,电离平衡向着逆向移动,溶液显示酸性;水的离子积受温度影响,温度不变,水的离子积不变.
解答:
解:水的电离平衡为:H2O?H++OH-,加入少量的KHSO4固体,溶液中氢离子浓度增大,抑制了水的电离,
A、加入硫酸氢钾后,溶液中氢离子浓度增大,溶液的pH减小,故A错误;
B、由于温度不变,水的离子积不变,即c(H+)和c(OH-)的乘积不变,故B错误;
C、硫酸氢钠电离出氢离子,水的电离平衡向着逆向移动,溶液中氢离子浓度增大,溶液pH减小,故C正确;
D、加入硫酸氢钾固体后,溶液中氢离子浓度增大,氢氧根离子浓度减小,故D错误;
故选C.
A、加入硫酸氢钾后,溶液中氢离子浓度增大,溶液的pH减小,故A错误;
B、由于温度不变,水的离子积不变,即c(H+)和c(OH-)的乘积不变,故B错误;
C、硫酸氢钠电离出氢离子,水的电离平衡向着逆向移动,溶液中氢离子浓度增大,溶液pH减小,故C正确;
D、加入硫酸氢钾固体后,溶液中氢离子浓度增大,氢氧根离子浓度减小,故D错误;
故选C.
点评:本题考查了影响水的电离平衡的因素,题目难度不大,注意酸溶液和碱溶液能够抑制水的电离,能够水解的盐溶液能够促进水的电离,试题侧重对学生基础知识的巩固和训练,意在巩固学生的基础,提高学生的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
以下说法正确的是( )
| A、同温同压下,相同体积的任何物质,物质的量也相同 |
| B、0.5mol氢的质量是0.5g |
| C、0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
| D、同质量的H2和Cl2相比,H2所含的分子数多 |
下列物质的水溶液中,除了水分子外,不存在其他分子的是( )
| A、HCl |
| B、NH4NO3 |
| C、Na2CO3 |
| D、HClO |
具有下列结构示意图的微粒,既可以是原子又可以是阴离子和阳离子的是( )
A、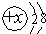 |
B、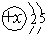 |
C、 |
D、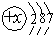 |
任何铵盐都具有的性质是( )
①都溶于水 ②都是晶体 ③都有氨的刺激性气味 ④加热后都放出氨气 ⑤与强碱混合加热都有氨气放出 ⑥加热后都会分解.
①都溶于水 ②都是晶体 ③都有氨的刺激性气味 ④加热后都放出氨气 ⑤与强碱混合加热都有氨气放出 ⑥加热后都会分解.
| A、①②③④ | B、①②⑤⑥ |
| C、①③⑤⑥ | D、②④⑤⑥ |
下列说法正确的是( )
| A、0.1mol/L NaHCO3溶液中:c(HCO3-)+c(CO32-)+c(OH-)>c(Na+)+c(H+)+c(H2CO3) |
| B、常温下,5mL 0.02mol/L HCl溶液与5mL 0.02mol/L Ba(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液pH=12 |
| C、相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸,三种溶液中由水电离产生的c(H+):①>②>③ |
| D、常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
已知:R-CH═CH
R-COOH+CO2↑,下列五种模型中小球代表质子数小于10的原子.下列有关推断正确的是( )

| 高锰酸钾溶液 |
| 稀硫酸酸化 |

| A、①和④代表的有机物都能与溴发生加成反应 |
| B、②和③代表的有机物都能发生取代反应和氧化反应 |
| C、用酸性高锰酸钾溶液可以除去有机物⑤中混有的有机物① |
| D、②和③代表的有机物所含官能团与葡萄糖相同 |
化学与环境、材料、能源关系密切,下列说法错误的是( )
| A、合成纤维、塑料、合成橡胶都是高分子化合物 |
| B、煤的气化和煤的液化都可以使煤变为清洁能源,煤的气化和煤的液化都属于物理变化 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、页岩气是从页岩层中开采出来的天然气.由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A、将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| B、pH均为9的三种溶液:CH3COOH、Na2CO3、NaOH,其物质的量浓度的大小顺序是NaOH 溶液>CH3COOH溶液>Na2CO3溶液 |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
| D、0.2mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合:c(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) |