题目内容
将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是( )。
| A.Fe与Al 的物质的量之比为1:1 |
| B.混合气体中NO为0.03mol ,N2O为0.12mol |
| C.原HNO3溶液的浓度C=4.9mol/L |
| D.反应中被还原的HNO3为0.15mol |
C
解析试题分析:向反应后的溶液中加入过量NaOH生成Fe(OH)3沉淀5.35g,则n(Fe)=0.05mol;由金属的总质量计算得n(Al)=0.15mol,两者的物质的量之比为1:2;由得失电子守恒,失电子总量为0.05×3+0.15×3=0.6mol,假设NO的物质的量为x,N2O的物质的量为y,得电子总量为(5-2)×x+2(5-1)×y=0.6,由混合气体在标况的体积3.36L,列式(x+y)=3.36L/22.4L/mol,得x=0.12mol,y=0.03mol;原溶液中硝酸的物质的量为表现酸性的部分+表现氧化性的部分+剩余的部分:n(HNO3)=0.05×3+0.15×3+0.12+0.03×2+1×0.2=0.98, C=4.9mol/L;其中被还原的部分为0.08mol。
考点:元素化合物知识。

下列化学应用中不涉及氧化还原反应的是
| A.Na2S水溶液在空气中变浑浊 |
| B.生活中使用明矾净水,除去水中的悬浮颗粒 |
| C.溶有二氧化氮的浓硝酸做火箭的助燃剂 |
| D.漂白粉漂白有色布条 |
需要加入适当的氧化剂才能实现的反应是
| A.MnO2 → Mn2+ | B.SO2 → SO32- |
| C.Cl2 → HCl | D.PCl3 → PCl5 |
一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L, 测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol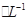 |
C.反应后溶液中c(NO3-)=1.6mol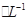 |
| D.反应后的溶液最多还能溶解1.6lgFe |
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
KMnO4+ FeSO4+ H2SO4= K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
下列说法正确的是
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Fe2+的还原性强于Mn2+ |
| C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成 |
| D.生成1mol水时,转移2.5mol电子 |
以下说法错误的是
| A.物质所含元素化合价升高的反应叫氧化反应 |
| B.金属阳离子在氧化还原反应中不一定作氧化剂 |
| C.含非金属元素的离子,在氧化还原反应中一定作还原剂 |
| D.非金属原子越容易得到电子,其单质氧化性越强 |
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
| A.浓硫酸的体积增大 | B.氢氧化钠的表面发生潮解 |
| C.铝的表面生成致密的薄膜 | D.澄清石灰水变浑浊 |
为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g。若硝酸的还原产物只有NO,下列说法正确的是
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应时有10 mol电子转移 |
C.产物中的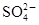 有一部分是氧化产物 有一部分是氧化产物 |
| D.FeS2只作还原剂 |