题目内容
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应时有10 mol电子转移 |
C.产物中的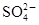 有一部分是氧化产物 有一部分是氧化产物 |
| D.FeS2只作还原剂 |
C
解析

练习册系列答案
相关题目
下列反应既属于氧化还原反应,又是吸热反应的是
| A.灼热的碳与CO2的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.铝片与稀盐酸的反应 | D.甲烷在氧气中的燃烧反应 |
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.磁性氧化铁中的铁元素全部被氧化 |
| C.稀HNO3在反应中只作氧化剂 |
| D.反应中每生成0.4 mol还原产物,就有1.2 mol电子转移 |
将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象
| A.水层显棕黄色 | B.水层无色 | C.四氯化碳层显红棕色 | D.四氯化碳层无色 |
将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是( )。
| A.Fe与Al 的物质的量之比为1:1 |
| B.混合气体中NO为0.03mol ,N2O为0.12mol |
| C.原HNO3溶液的浓度C=4.9mol/L |
| D.反应中被还原的HNO3为0.15mol |
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN 可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂 | B.N2被氧化 |
| C.AlN的摩尔质量为41 g | D.生成1 mol AlN转移3 mol电子 |
已知氧化性:Cl2>IO3—>Fe3+>I2,以下实验的结论或实验的预测合理的是( )
| A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I- |
| B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色 |
| C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有IO3— |
| D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成 |
硫氰(SCN)2的化学性质和卤素(X2)类似,称为拟卤素,如(SCN)2+H2O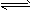 HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是( )
HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是( )
| A.Cl2可以与KSCN溶液反应 |
| B.(SCN)2可以与KI溶液反应 |
| C.KSCN溶液可以与FeCl3溶液反应 |
| D.(SCN)2可以与KBr溶液反应 |
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A.原混合物中铜和铁各0.15 mol |
| B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 |
| D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |