题目内容
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
| A.浓硫酸的体积增大 | B.氢氧化钠的表面发生潮解 |
| C.铝的表面生成致密的薄膜 | D.澄清石灰水变浑浊 |
C
解析试题分析:A、浓硫酸有吸水性,放在空气中会吸收空气中的水分而使体积增大,发生了物理变化、化学变化,但由于元素的化合价没有变化,所以没有发生氧化还原反应。错误。B、氢氧化钠吸收空气中的水蒸气而在固体表面形成浓溶液,这种现象叫做潮解。没有新物质生成,是物理变化。错误。C.4Al+ 3O2 =2Al2O3.有新物质生成,是化学变化,同时元素的化合价发生了变化,也是氧化还原反应。正确。D. Ca(OH)2+CO2=CaCO3↓+H2O。发生的是化学变化,因为在反应前后元素的化合价没有发生变化,所以不是氧化还原反应。错误。
考点:考查物质久置于空气中会发生相应的变化的所属类别的知识。

将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是( )。
| A.Fe与Al 的物质的量之比为1:1 |
| B.混合气体中NO为0.03mol ,N2O为0.12mol |
| C.原HNO3溶液的浓度C=4.9mol/L |
| D.反应中被还原的HNO3为0.15mol |
下列叙述中正确的是
| A.氧化还原反应的实质是元素化合价的升降 |
| B.非金属元素从化合态变为游离态时,该元素一定被氧化 |
| C.氧化剂氧化其他物质时本身一定被还原 |
| D.具有氧化性的物质在反应中一定做氧化剂 |
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是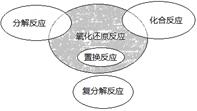
| A.4NH3 +5O2 =4NO+6 H2O |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl +Br2 |
根据反应①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
| A.Fe3+>Cl2>I2 | B.Cl2>I2>Fe3+ | C.I2>Cl2>Fe3+ | D.Cl2>Fe3+>I2 |
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN 可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂 | B.N2被氧化 |
| C.AlN的摩尔质量为41 g | D.生成1 mol AlN转移3 mol电子 |
关于反应CaO + 3C→CaC2 + CO,下面哪种表述能最好地说明该反应是一个氧化还原反应
| A.CaO失氧变为CaC2 |
| B.碳元素失去了电子,同时也得到了电子 |
| C.钙元素的化合价在反应前后发生了改变 |
| D.单质碳的状态发生了变化 |
水热法制备纳米颗粒Y(化合物)的反应为
3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32-是还原剂 |
| D.每有1 mol O2参加反应,转移的电子总数为4 mol |
硫氰(SCN)2的化学性质和卤素(X2)类似,称为拟卤素,如(SCN)2+H2O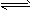 HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是( )
HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是( )
| A.Cl2可以与KSCN溶液反应 |
| B.(SCN)2可以与KI溶液反应 |
| C.KSCN溶液可以与FeCl3溶液反应 |
| D.(SCN)2可以与KBr溶液反应 |