题目内容
9.(1)在下列物质中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2、CH3COONa,用化学式回答下列问题:①只由非金属组成的离子化合物是NH4Cl,
②只有极性共价键的共价化合物是CO2,
③只含有非极性共价键的是物质是I2,
④既有离子键又有非极性键的化合物是Na2O2,
⑤既有离子键又有非极性键和极性键的化合物是CH3COONa,
(2)在下列物质中,①${\;}_{3}^{6}$Li ②${\;}_{11}^{23}$Na ③${\;}_{12}^{24}$Mg ④${\;}_{3}^{7}$Li ⑤${\;}_{6}^{14}$C ⑥C60⑦石墨,互为同位素的是①④,互为同素异形体的是⑥⑦.(填编号)
分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物;
(2)同位素是质子数相同,而中子数不同的原子;同素异形体是同种元素形成的不同单质.
解答 解:(1)H2O2 含有H-O极性键和O-O非极性键,属于共价化合物;
Na2O中只含离子键,属于离子化合物;
I2为单质,含有非极性键,
NaCl为离子化合物,只含有离子键;
CO2只含极性键,属于共价化合物;
NH4Cl中含有离子键和极性键,属于离子键化合物;
Na2O2中含有离子键和非极性键,属于离子键化合物;
CH3COONa中含有离子键、极性键和非极性键,属于离子键化合物,
故答案为:①NH4Cl;②CO2;③I2;④Na2O2;⑤CH3COONa;
(2)根据同位素是质子数相同,而中子数不同的原子,36Li、37Li的质子数是3,中子数分别为3、4,
根据同素异形体是同种元素形成的不同单质,C60、石墨两者是由碳元素形成的不同单质,
故答案为:①④;⑥⑦.
点评 本题考查较为综合,涉及物质和化学键的关系,以及同位素、同素异形体的概念,为高频考点,侧重于基础知识的学习,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
20.下列关于ⅦA族元素的叙述正确的是( )
| A. | ⅦA族元素是同周期中原子半径最大的元素 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | ⅦA族元素的最高正价都是+7价 | |
| D. | ⅦA族元素是同周期中非金属性最弱的元素 |
17. 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置R如上表所示;下列说法
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置R如上表所示;下列说法
正确的是( )
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置R如上表所示;下列说法
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置R如上表所示;下列说法正确的是( )
| A. | X的最高价氧化物的水化物不能与它的氢化物反应 | |
| B. | Y原子的电子总数是其K层电子数的3倍 | |
| C. | Z在高温下可与铁的氧化物发生铝热反应 | |
| D. | Q的单质能与W的氢化物发生置换反应 |
4.下列能级中轨道数为7的是( )
| A. | s能级 | B. | p能级 | C. | d能级 | D. | f能级 |
18.几种短周期元素的原子半径及主要化合价如表,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | - |
| 最低负价 | - | -1 | - | - | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | M(OH)2的碱性比XOH的碱性强 |
19.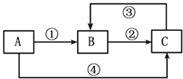 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )| A. | ①中所加试剂可能是氯气 | |
| B. | ③中需要加具有氧化性的试剂 | |
| C. | A与稀硝酸反应一定能实现元素M在①中发生的价态变化 | |
| D. | 元素M在②中发生的价态变化也能通过加碘化钾溶液实现 |