题目内容
4.常温下,下列关系正确的是( )| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
分析 A.根据反应后的溶液中的电荷守恒分析;
B.pH=8.3的NaHCO3溶液呈碱性,说明HCO3-的电离程度小于其水解程度,则c(H2CO3)>c(CO32-);
C.反应后生成等浓度的醋酸和醋酸钠,根据混合液中的电荷守恒、物料守恒分析;
D.氯化银与铬酸银的沉淀类型不同,不能直接根据其溶度积判断溶解度大小.
解答 解:A.溶液存在电荷守恒,根据溶液中的电荷守恒可得:c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;
B.碳酸氢钠溶液的pH=8.3,溶液呈碱性,说明碳酸氢根离子的水解大于电离,水解生成H2CO3而电离产生CO32-,钠离子不水解,HCO3-存在两种趋势,但两种趋势都极其微弱,故离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,反应后的溶液中含有等浓度的醋酸和醋酸钠,根据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),根据物料守恒可得:2c(Na+)=c(CH3COO-)+c(CH3COOH),二者结合可得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故C正确;
D.AgCl与Ag2CrO4的沉淀类型不同,需要通过计算才能判断其溶解度大小,不能直接根据溶度积数值大小判断难溶程度,故D错误;
故选C.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握判断溶液中离子浓度大小的方法,明确电荷守恒、物料守恒及盐的水解原理的应用,选项D为易错点,注意氯化银与铬酸银为不同类型的沉淀,不能直接以溶度积大小判断其溶解度大小.

练习册系列答案
相关题目
14.制取纯净的一氯乙烷的最佳方法是( )
| A. | 乙烷和氯气在一定条件下发生取代反应 | |
| B. | 乙烯和氯气在一定条件下发生加成反应 | |
| C. | 乙炔与氯化氢加成后再加氢 | |
| D. | 乙烯与氯化氢发生加成反应 |
12.高中阶段我们相继学习了同位素、同素异形体、同分异构体、同系物的概念,下列有关这四个概念说法不正确的是( )
| A. | 因为C2H6与C3H8互称同系物,所以C4H8与C6H12一定互称同系物 | |
| B. | 氕、氘、氚互称同位素 | |
| C. | O2与O3、红磷与白磷、金刚石与石墨互称同素异形体 | |
| D. | 邻二甲苯、间二甲苯、对二甲苯互称同分异构体 |
19.下列图示内容的对应说明错误的是( )
| A | B | C | D | |
| 图示 |  | 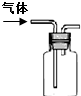 |  |  |
| 说明 | 主要成分是蔗糖作调味剂 | 该装置可以收集二氧化氮 | 该装置可保护钢阀门不被腐蚀 | 该仪器用于配制一定质量分数的溶液 |
| A. | A | B. | B | C. | C | D. | D |
9.已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期.X和Y能形成两种常见共价化合物,Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2.下列说法错误的是( )
| A. | Y、Z、X、W的原子序数依次减小 | |
| B. | X的简单氢化物的沸点低于Y的简单氢化物的沸点 | |
| C. | 由W、X、Y、Z四种元素组成的化合物可能显强酸性 | |
| D. | W和X形成的化合物,与W和Y形成的化合物中各元素质量比可能相同 |
16.在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )
| A. | 溶液中2c(Na+)=c(SO42-) | B. | 0<沉淀的物质的量<$\frac{a}{2}$ mol | ||
| C. | 沉淀的物质的量$\frac{a}{2}$ mol | D. | 原溶液中c(H2SO4)=$\frac{a}{2}$ mol•L-1 |

 →
→ ,.
,. .
.