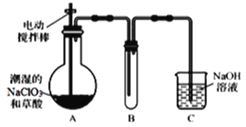
题目内容
【题目】在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)![]() CO(g)+H2(g);(乙)CO(g)+H2O(g)
CO(g)+H2(g);(乙)CO(g)+H2O(g)![]() CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A. ①②⑤B. ③④⑥C. ①⑥D. ⑥
【答案】D
【解析】
①由于乙反应的两边气体的系数和相同且都是气体,平均相对分子质量始终不变,所以平均相对分子质量不再不变,无法判断乙反应是否达到平衡状态,故不选①;
②乙反应的两边气体的系数和相同,反应中压强始终不变,所以压强不变无法判断乙是否达到平衡状态,故不选②;
③各气体组分浓度相等,不能判断各组分的浓度不变,无法证明反应达到了平衡状态,故不选③;
④由于乙反应的两边都是气体,容器的容积不变,密度始终不变,所以混合气体的密度保持不变,无法判断乙是否达到平衡状态,故不选④;
⑤单位时间内,消耗水质量与生成氢气质量比为9∶1,水与氢气的物质的量之比为1∶1,表示的都是正反应速率,无法判断正逆反应速率相等,故不选⑤;
⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量,说明正逆反应速率相等,能说明达到了平衡状态,故选⑥;
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目