题目内容
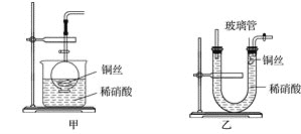
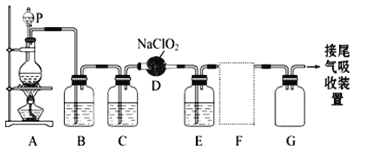
【题目】ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
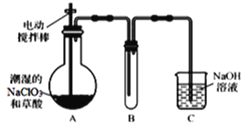
(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是________。
(2)装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
【答案】温度过低,化学反应速率较慢,温度过高草酸升华或分解 水浴加热 2NaClO3+H2C2O4![]() Na2CO3+CO2↑+2ClO2↑+H2O 2ClO2+2OH-=ClO3-+ClO2-+H2O
Na2CO3+CO2↑+2ClO2↑+H2O 2ClO2+2OH-=ClO3-+ClO2-+H2O
【解析】
装置A中盛放草酸和NaClO3,反应生成ClO2气体,发生2NaClO3+H2C2O4 ![]() Na2CO3+CO2↑+2ClO2↑+H2O,装置A用电动搅拌棒,将反应物充分混合(或充分反应、或使反应物受热均匀),B为ClO2的凝集装置,装置C为尾气吸收装置。
Na2CO3+CO2↑+2ClO2↑+H2O,装置A用电动搅拌棒,将反应物充分混合(或充分反应、或使反应物受热均匀),B为ClO2的凝集装置,装置C为尾气吸收装置。
(1)一般来说,升高温度,活化分子的百分数增大,反应速率增大,温度过低,化学反应速率较慢,无水草酸100℃可以升华,温度过高草酸升华或分解,所以实验时装置A需在60℃~100℃进行,反应温度低于水的沸点,用水浴可使反应容器受热均匀,所以反应要用水浴加热;
(2)装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,方程式为2NaClO3+H2C2O4![]() Na2CO3+CO2↑+2ClO2↑+H2O;
Na2CO3+CO2↑+2ClO2↑+H2O;
(3)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,反应的离子方程式为:2ClO2+2OH-=ClO3-+ClO2-+H2O。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol]:下列说法正确的是( )
2NH3(g)△H=﹣92.4kJ/mol]:下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3 B. a+b>92.4 C. 2p2<p3 D. α1+α3<1