题目内容
【题目】向含有4 mol HNO3和1 mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。
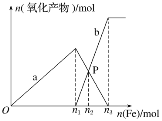
(1)b表示的关系曲线_______(填离子符号)
(2)n1=______
(3)P点时,n(Fe2+)=______mol
(4)向P点溶液中加入铜粉,最多可溶解________g
【答案】Fe2+ 1.5 0.9 28.8
【解析】
铁与稀硝酸反应时首先生成的是Fe3+,当硝酸全部反应后,Fe3+与Fe会发生反应生成Fe2+,当n(Fe)为n2时,Fe3+ 与Fe2+的物质的量相等;若M点时再加入稀硝酸时,Fe2+与稀硝酸反应生成Fe3+、NO和H2O。
(1)曲线a对应的反应是铁与硝酸反应生成Fe(NO3)3、NO和H2O,离子方程式为:![]() ,曲线b对应的反应是Fe与Fe3+反应生成Fe2+的情况,曲线b代表的微粒为Fe2+;故答案为:Fe2+;
,曲线b对应的反应是Fe与Fe3+反应生成Fe2+的情况,曲线b代表的微粒为Fe2+;故答案为:Fe2+;
(2)在4 mol HNO3和1 mol H2SO4的混合溶液中,n(H+)=6mol,n1对应Fe的物质的量是恰好与稀硝酸反应生成Fe3+时的Fe消耗量,根据以下离子方程式可以求得n1,
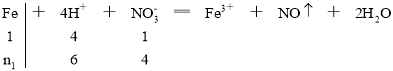
由反应可知,氢离子消耗完,硝酸根过量,故n1=1.5mol,故答案为:1.5;
(3)曲线b对应的反应是Fe与Fe3+反应生成Fe2+的情况,P点时,Fe3+ 与Fe2+的物质的量相等;根据以下离子方程式可以求得此反应中消耗Fe的物质的量,

1.52x=3x x=0.3
n(Fe2+)=3x=0.9mol,故答案为:0.9;
(4)P点溶液中含有0.9mol Fe3+,与铜发生反应:
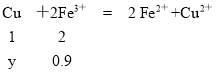
y=0.45mol,m(Cu)= ![]() ,故答案为:28.8。
,故答案为:28.8。

 阅读快车系列答案
阅读快车系列答案【题目】I. 合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
II.(1)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K=_____(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
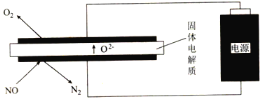
阴极的电极反应式为___________________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________。
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:

已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
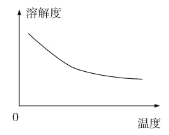
②碳酸锂的溶解度与温度关系如图所示:
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。