题目内容
下列说法中不正确的是( )
| A、在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| B、C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键 |
| C、同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 |
| D、由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键 |
考点:配合物的成键情况,极性键和非极性键,氢键的存在对物质性质的影响
专题:化学键与晶体结构
分析:A.根据形成配位键的条件,一方提供孤电子对,一方提供空轨道,可以作判断;
B.某些含N-H、O-H、F-H的化合物能形成氢键,氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点;
C.同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物不能形成共价化合物;
D.由两种非金属元素组成的化合物分子中可能有极性键,也可能会有非极性键;
B.某些含N-H、O-H、F-H的化合物能形成氢键,氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点;
C.同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物不能形成共价化合物;
D.由两种非金属元素组成的化合物分子中可能有极性键,也可能会有非极性键;
解答:
解:A.NH3中的氮原子上的孤电子对,可以形成配位键,所以铵根离子中存在四个N-H共价键,其中一个是配位键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,故A正确;
B.C2H5OH是含O-H的化合物,能形成分子间氢键,C2H5Br不能,氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点,所以前者的沸点远高于后者,故B正确;
C.同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物,如第三周期元素,同周期ⅠA族Na元素和ⅦA族Cl元素之间能形成离子化合物NaCl,故C正确;
D.由两种非金属元素组成的化合物分子中不一定仅含极性键,如过氧化氢,过氧化氢的电子式为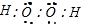 ,结构式为H-O-O-H,由两种非金属元素组成,既有氢氧间的极性键,也有氧氧间的非极性键,故D错误;
,结构式为H-O-O-H,由两种非金属元素组成,既有氢氧间的极性键,也有氧氧间的非极性键,故D错误;
故选D.
B.C2H5OH是含O-H的化合物,能形成分子间氢键,C2H5Br不能,氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点,所以前者的沸点远高于后者,故B正确;
C.同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物,如第三周期元素,同周期ⅠA族Na元素和ⅦA族Cl元素之间能形成离子化合物NaCl,故C正确;
D.由两种非金属元素组成的化合物分子中不一定仅含极性键,如过氧化氢,过氧化氢的电子式为
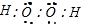 ,结构式为H-O-O-H,由两种非金属元素组成,既有氢氧间的极性键,也有氧氧间的非极性键,故D错误;
,结构式为H-O-O-H,由两种非金属元素组成,既有氢氧间的极性键,也有氧氧间的非极性键,故D错误;故选D.
点评:本题考查了配位键、氢键、元素在周期表中的位置与性质间的关系,极性键与非极性键,题目难度中等,注意D由两种非金属元素组成的化合物分子中可能有极性键,也可能会有非极性键,为该题易错点.

练习册系列答案
相关题目
下列有关原子结构和元素周期律的表述中不正确的是( )
①原子序数为l5的元素的氢化物为三角锥形
②ⅦA族元素是同周期中非金属性最强的元素
③第三周期ⅣA族元素的原子核电荷数和中子数均为6
④原子序数为26的元素位元素周期表的第四周期第ⅧB族.
①原子序数为l5的元素的氢化物为三角锥形
②ⅦA族元素是同周期中非金属性最强的元素
③第三周期ⅣA族元素的原子核电荷数和中子数均为6
④原子序数为26的元素位元素周期表的第四周期第ⅧB族.
| A、①② | B、①③ | C、②④ | D、③④ |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、等物质的量的H2和N2所含分子数均为NA |
| B、标准状况下,11.2L的己烷含有分子数为0.5NA |
| C、常温常压下,46g NO2含有原子数为3NA |
| D、1mol SiO2晶体中含NA个SiO2分子 |
下列离子方程式书写正确的是( )
| A、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | ||||
B、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C、将H2O2滴加到酸性KMnO4溶液中:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O | ||||
| D、向含有FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
在NH4HSO3溶液中逐滴加入Ba(OH)2溶液,下列离子方程式一定错误的是( )
| A、2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O |
| B、NH4++HSO3-+Ba2++2OH-→BaSO3↓+NH3?H2O+H2O |
| C、NH4++3HSO3-+2Ba2++4OH-→2BaSO3↓+SO32-+NH3?H2O+3H2O |
| D、HSO3-+Ba2++OH-→BaSO3↓+H2O |
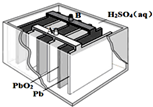 铅蓄电池是最常见的二次电池,其构造示意图如图.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如图.发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)
| 放电 |
| 充电 |
| A、放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
| B、铅蓄电池广泛用于汽车启动电源,可以边使用边充电,充电时,应将充电电源的正极与铅蓄电池的接线柱A相接 |
| C、实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D、铅蓄电池做电源电解AgNO3溶液,当有标况下11.2升O2产生时,消耗2mol H2SO4 |
有X,Y两种原子,对它们结构的下列描述中,能说明彼此化学性质一定相似的是( )
| A、电子排布式分别为:1s2和1s22s2 |
| B、X原子M层上只有两个电子,Y原子N层上也只有两个电子 |
| C、X原子的2p亚层上有二对成对电子,Y原子的3p亚层上也有二对成对电子 |
| D、X原子的2p亚层上只有一个未成对电子,Y原子的3p亚层上只有一个未成对电子 |
1mol某烷烃完全燃烧,需要5mol氧气,这种烷烃的化学式( )
| A、CH4 |
| B、C2H6 |
| C、C3H8 |
| D、C4H10 |