题目内容
【题目】W、X、Y、Z是四种原子序数依次增大的短周期元素,W、X两种元索可组成W2x和W2X2两种常见的无色液体化合物, Y2X2为淡黄色固体化合物,Z的原子序数是X的原子序数的两倍。请回答下列问题:
(1)Z元素的名称是___________ 。
(2)W、X、Y三种元素形成的化合物的电子式_____________
(3)写出Y2X2中所含化学键有:___________。
(4)写出Y2X2和W2X反应的化学方程式:_______________
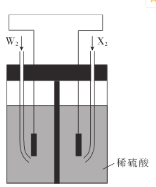
(5)W2和X2是组成某种燃料电池的两种常见物质,如图所示,通人X2的电极是___(填“正极”或“负极”),写出通人W2的电极的电极反应式:________________
【答案】硫 ![]() 离子键和共价键 2Na2O2 + 2H2O=4NaOH + O2↑ 正 H2-2e-=2H+
离子键和共价键 2Na2O2 + 2H2O=4NaOH + O2↑ 正 H2-2e-=2H+
【解析】
W、X两种元素可组成W2X和W2X2两种常见的无色液体化合物,故W为H元素;X为O元素;Y2X2为淡黄色固体化合物,故Y为Na元素;Z的原子序数是X的原子序数的两倍,故Z为S元素,据此进行分析。
W、X两种元素可组成W2X和W2X2两种常见的无色液体化合物,故W为H元素;X为O元素;Y2X2为淡黄色固体化合物,故Y为Na元素;Z的原子序数是X的原子序数的两倍,故Z为S元素;
(1) Z元素的名称是S元素;
(2)W、X、Y三种元素分别为H、O、Na,形成的化合物是NaOH,是离子化合物,其电子式为![]() ;
;
(3) Y2X2为Na2O2,是离子化合物,所含化学键有离子键和共价键;
(4) Y2X2为Na2O2,W2X为H2O,两者反应生成NaOH和O2,反应的化学方程式为2Na2O2 + 2H2O=4NaOH + O2↑;
(5) X2为O2,氢氧燃料电池,负极通氢气,正极通氧气,发生还原反应,故通入O2的电极是正极;W2为H2,通H2的极负极,负极发生氧化反应,故电极反应方程式为H2-2e-=2H+。

【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___点(选填“D”、“E”或“F”)。
(3)已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
该反应是____反应(填“吸热反应”或“放热反应”);反应初始至平,A的平均反应速率v(A)=_____。达到平衡后,B的转化率为____。