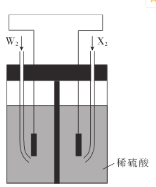
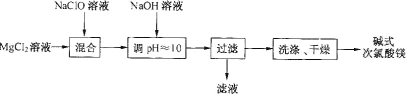
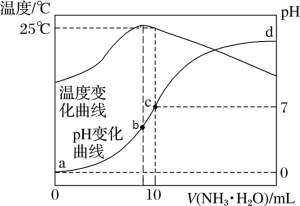
题目内容
【题目】科学家合成出了一种用于分离镧系金属的化合物 A,其结构如下图所示。短周期元素 X、Y、Z原子序数依次增大,其中Z位于第三周期。Z与Y可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于X、Y、Z的叙述,正确的是

A.化合物 A中,X、Y、Z最外层都达到8电子稳定结构
B.离子半径:Y>Z
C.最简单氢化物的沸点:Z>Y
D.最高价氧化物对应水化物的酸性:Z<X
【答案】A
【解析】
根据图示A的结构可知,正离子中Z失去一个电子后形成3个共价键,说明Z原子最外层为6个电子,且Z位于第三周期,则Z为S;负离子中Y形成一个共价键,为-1价,不是第三周期元素,且原子序数大于X,应为F(当然不是H,因为正离子已经有H);X得到一个电子形成4个共价键,说明其最外层为3个电子,则X为B元素,据此解答。
根据分析可知,X为B,Y为F,Z为S元素;
A.结合分析可知,化合物A分子中B、F、S元素最外层都达到8电子稳定结构,其中B原子周围形成3个共价键和1个配位刍键,故A正确;
B.电子层越多离子半径越大,则离子半径F-<S2-,即Y<Z,故B错误;
C.在标准状况下,HF为液体,而H2S为气体,则最简单氢化物的沸点:HF>H2S,即Y >Z,故C错误;
D.非金属性越强,最高价含氧酸的酸性越强,非金属性:B<S,则最高价氧化物对应水化物的酸性:H3BO3(弱酸)<H2SO4(强酸),即X<Z,故D错误;
故答案为A。

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目