题目内容
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:将Fe3+转化为Fe2+
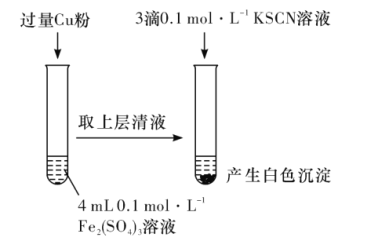
(1)Fe3+与Cu粉发生反应的离子方程式为__。
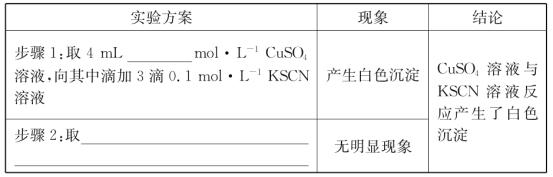
(2)探究白色沉淀产生的原因,请填写实验方案:__、__。
查阅资料:
已知:①SCN-的化学性质与I-相似。
②2Cu2++4I-=2CuI↓十I2。
则Cu2+与SCN-反应的离子方程式为__。
实验II:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因:__。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应,
反应II:Fe2+与NO反应。
①依据实验现象,可推知反应I的速率比反应II__(填“快"或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明___。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:___。
【答案】2Fe3++Cu═2Fe2++Cu2+ 0.1mol/L 取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 2Cu2++4SCN=2CuSCN↓+(SCN)2 3Fe2++4H++NO3═3Fe3++NO↑+2H2O 慢 取反应后的黄色溶液于试管中,向其中加入几滴K3Fe(CN)6溶液,无明显变化,说明反应Ⅰ是不可逆反应 导致Fe2+浓度降低,使平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色
【解析】
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子;
(2)图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验;由题目信息ii可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2;
(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水;
(4)①反应速率快的反应现象最先表现;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,可以用K3[Fe(CN)6]溶液检验;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡发生移动,最终Fe(NO)2+完全转化为Fe3+。
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子,反应离子方程式:2Fe3++Cu═2Fe2++Cu2+;
(2)由反应2Fe3++Cu═2Fe2++Cu2+,可知图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验,故实验方案为:步骤1:取4mL0.1mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液,步骤2:取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液,由题目信息ii可知,Cu2+与SCN反应生成CuSCN沉淀,同时生成(SCN)2,反应离子方程式为:2Cu2++4SCN=2CuSCN↓+(SCN)2;
(3)铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水,反应离子方程为:3Fe2++4H++NO3═3Fe3++NO↑+2H2O;
(4)①溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,反应Ⅰ的速率比反应Ⅱ的慢;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是:取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色。