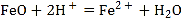题目内容
【题目】为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀,离子方程式为:C2O42-+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4=H2C2O4+CaSO4,再用蒸馏水稀释溶液至V0mL。取出V1mL用a mol/L的KMnO4酸性溶液滴定,此时发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,若滴定终点时消耗a mol/L的KMnO4V2mL,样品中CaCO3的质量分数为_______。
【答案】ω(CaCO3)=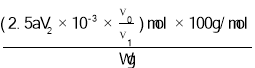 ×100%=
×100%=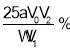
【解析】
根据Ca原子、草酸根离子守恒得5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,根据碳酸钙和高锰酸根离子之间的关系式计算。
根据Ca原子、草酸根离子守恒得5CaCO3~5CaC2O4~5H2C2O4~2MnO4-,设V1mL的溶液中,高锰酸钾溶液消耗的碳酸钙的物质的量为x,
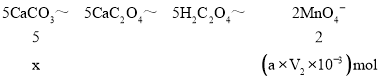
![]() ,x=
,x=![]() mol=2.5aV2×103mol,
mol=2.5aV2×103mol,
则V0mL溶液中n(CaCO3)=![]() ×V0×103mol=
×V0×103mol=![]() mol,
mol,
ω(CaCO3)=![]() ×100%=
×100%=![]() ×100%=
×100%=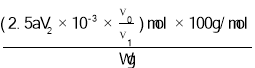 ×100%=
×100%=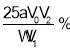 。
。

【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体/ml | 280 | 336 | 336 |
(1)该盐酸的物质的量浓度____________;
(2)合金中Mg、Al的物质的量之比为___________;
(3)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为AlO2-,并使Mg2+刚好沉淀完全,则溶液中AlO2-的物质的量为__________mol;溶液中Na+的物质的量为_________mol;所加NaOH溶液的体积为_________mL。
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2 )在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH 3OH(g)+H2O(g) △H2
CH 3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ mol-1) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
(1)CH3OH中氧在周期表中位于___,属于___区元素,与其同周期相邻两种元素原子的第一电离能由大到小的顺序为___(用元素符号表示),其原因是___。
(2)写出CH3OH的结构式___;反应①的热化学方程式(热量用具体数值表示)___。
(3)当△H2=-58kJ mol-1,则△H3=__kJ mol-1。
(4)CO和H2的混合气体又称水煤气,可由水和煤在一定条件下产生,写出该反应的化学方程式___。