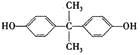
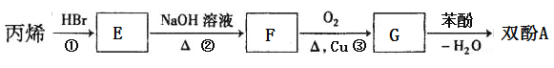
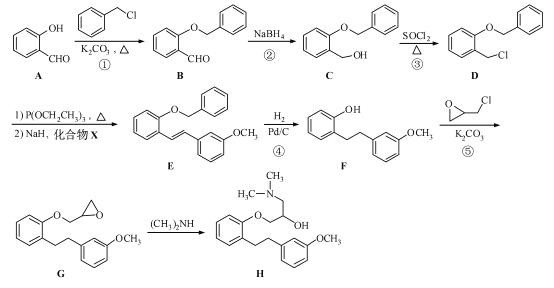
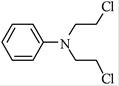
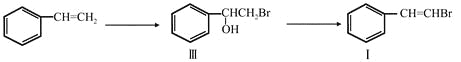
题目内容
【题目】一氧化二氯(Cl2O)是一种常用的氯化剂。常温下,Cl2O是棕黄色、有刺激性气味的气体,熔点为-120.6℃,沸点为2.0℃,易与水反应生成次氯酸。实验室欲用氯气通入含水8%的碳酸钠固体中制备并收集少量纯净的Cl2O,请用下列装置设计实验并探究相关物质的性质。
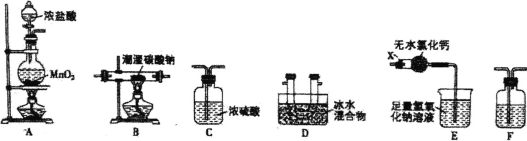
(1)装置E中仪器X的名称为_________。
(2)装置的连接顺序是A_______(每个装置限用一次)。
(3)装置F中盛装试剂的名称为_____,装置E中无水氯化钙的作用是_____。
(4)装置B残留固体中除NaCl外还含有一种酸式盐M,写出装置B中发生反应的化学方程式_____________。
(5)测定残留固体中M的质量分数:取m g样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1 mol/L的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1 mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2 mL。
①实验时用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、锥形瓶、___。
②求残留固体中M的质量分数___(用含m、V1和V2的代数式表示)。
③若用甲基橙作指示剂滴定结束时,滴定管尖头有气泡,测定结果将填_____(“偏高"、“偏低”或“不变”)。
【答案】干燥管 FBCDE 饱和食盐水 防止E中的水进入D中发生反应 2Na2CO3+H2O+2Cl2![]() 2NaCl+2NaHCO3+Cl2O 酸式滴定管
2NaCl+2NaHCO3+Cl2O 酸式滴定管 ![]() ×100% 偏低
×100% 偏低
【解析】
利用A装置发生反应制取Cl2,由于浓盐酸具有挥发性,制取的氯气中混有杂质HCl,为防止干扰Cl2O的制取,需要先用装置F除去HCl杂质,再利用装置B发生反应2Na2CO3+H2O+2Cl2![]() 2NaCl+2NaHCO3+Cl2O制取Cl2O,由于Cl2O易溶于水,同时与水反应生成次氯酸,所以收集前要通过C装置干燥,再利用装置D收集Cl2O,并验证其沸点低、易液化的特点,同时由于氯气、Cl2O都是大气污染物,最后要用E装置进行尾气处理,以此来解答。
2NaCl+2NaHCO3+Cl2O制取Cl2O,由于Cl2O易溶于水,同时与水反应生成次氯酸,所以收集前要通过C装置干燥,再利用装置D收集Cl2O,并验证其沸点低、易液化的特点,同时由于氯气、Cl2O都是大气污染物,最后要用E装置进行尾气处理,以此来解答。
(1)根据装置图可知装置E中仪器X的名称为干燥管;
(2)A装置制取氯气,由于浓盐酸具有挥发性,所以制取的氯气中混有杂质HCl,为防止干扰Cl2O的制取,需要先用盛有饱和NaCl的水溶液的装置F除去杂质HCl气体,再利用装置B制取Cl2O。Cl2O易溶于水,同时与水反应生成次氯酸,所以收集前要通过盛有浓硫酸的C装置干燥气体,再利用装置D收集Cl2O,并验证其沸点低、易液化的特点,同时由于氯气、Cl2O都是大气污染物,最后要用E装置进行尾气处理,则按气体从左至右流动装置连接顺序是AFBCDE;
(3)装置F中盛装试剂的名称为饱和食盐水,可除去氯气中的HCl,装置E中无水氯化钙的作用是防止E中的水进入D中发生反应;
(4)装置B中反应制取Cl2O,发生反应的化学方程式为2Na2CO3+H2O+2Cl2![]() 2NaCl+2NaHCO3+Cl2O;
2NaCl+2NaHCO3+Cl2O;
(5)①采用滴定方法,用盐酸标准溶液测定待测溶液的浓度,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、锥形瓶及酸式滴定管;
②滴加盐酸发生CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,残留固体中M的质量分数为![]() ×100%;
×100%;
③用甲基橙作指示剂滴定结束时,滴定管尖头有气泡,则V2偏小,导致测定结果将偏低。