题目内容
【题目】为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图)。
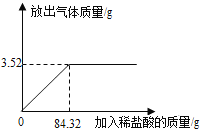
(1)碳酸钙完全反应用去稀盐酸的质量为__________g。
(2)该石灰石样品中碳酸钙的质量分数为_________。
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是_____________
【答案】84.32 80% 10%
【解析】
(1)图象的转折点是二者恰好反应的点,观察图象可知此时用去稀盐酸的质量;
(2)根据二氧化碳的质量可求出碳酸钙的质量,进而求出石灰石样品中碳酸钙的质量分数;
(3)根据二氧化碳的质量可求出生成的氯化钙的质量,并根据质量守恒定律求出所得溶液的质量,再根据溶质的质量分数进行解答
(1)图象的转折点是二者恰好反应的点,观察图象可知此时用去稀盐酸的质量为84.32g;
(2)据图象可知:该样品最多与盐酸反应生成二氧化碳3.52g;
设碳酸钙的质量为x,生成的氯化钙质量为y,

![]() ,
,![]() ,解得:x=8g,y=8.88g,
,解得:x=8g,y=8.88g,
则该石灰石样品中碳酸钙的质量分数=![]() ×100%=80%
×100%=80%
(3)反应后氯化钙溶液的质量为:=m(盐酸)+m(样品)-m(CO2)-m(杂质)=84.32g+10g-3.52g-(10g-8g)=88.8g,所得溶液中溶质质量分数是=![]() ×100%=10%。
×100%=10%。

【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D
【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体/ml | 280 | 336 | 336 |
(1)该盐酸的物质的量浓度____________;
(2)合金中Mg、Al的物质的量之比为___________;
(3)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为AlO2-,并使Mg2+刚好沉淀完全,则溶液中AlO2-的物质的量为__________mol;溶液中Na+的物质的量为_________mol;所加NaOH溶液的体积为_________mL。