题目内容
【题目】第五主族的磷单质及其化合物在工业上有广泛应用.
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,则△H=______;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为______,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______;

(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍.
①化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性等条件下发生下述反应:
(a) Ni2++ H2PO2﹣+ → Ni++ H2PO3﹣+
(b)6H2PO﹣2+2H+═2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a) ___________________________;
②利用①中反应可在塑料镀件表面沉积镍﹣磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______;
原理上的不同点:______;
化学镀的优点:______.
【答案】(1) △H1—3△H2+18△H3 (2分)
(2) (2分) ,Na5P3O10(2分)
(2分) ,Na5P3O10(2分)
(3)①2Ni2++1H2PO2-+1H2O→2Ni++1H2PO3-+2H+(3分)
②化学镀中镀件直接与电解质溶液接触反应;(2分)
电镀通过外加电流,在镀件外形成镀层;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应; (2分)
装置简便,节约能源,操作简便 (2分)
【解析】
试题(1)热化学方程式4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4可以将下列三个反应相加得到:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1;6Ca3(PO4)2(s)+30C(s)=3P4(g)+18CaO(s)+30CO(g)3△H2;18SiO2(s)+18CaO(s)=18CaSiO3(s)18△H3;根据盖斯定律可得△H=△H1+3△H2+18△H3。
(2)一个磷酸中的羟基与另一个磷酸的H之间可以脱水.结构式则为 ;“五钠”即五个钠原子,所以三聚磷酸钠的化学式为Na5P3O10。
;“五钠”即五个钠原子,所以三聚磷酸钠的化学式为Na5P3O10。
(3)①(a)根据得失电子守恒:镍元素的化合价降低了1价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+2Ni2++H2PO2-+═2Ni++H2PO3-+2H+。
②从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,电镀通过外加电流,在镀件外形成镀层,化学镀是利用化学腐蚀反应,电镀是利用电解池,外加电流进行氧化还原反应;化学镀的优点为:装置简便,节约能源,操作简便,化学镀对镀件的导电性无特殊要求。

 阅读快车系列答案
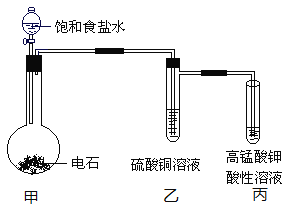
阅读快车系列答案【题目】ClO2是一种易溶于水难溶于有机溶剂的气体,在自来水消毒和果蔬保鲜等方面应用广泛。某同学在实验室中制取ClO2,并探究其性质。回答下列问题:
Ⅰ.ClO2的制备
实验室制备ClO2的反应原理为2NaClO2 + Cl2 = 2ClO2 + 2NaCl,装置如下图所示:

(1)装置A烧瓶中发生反应的离子方程式为___________________________。
(2)装置B中盛放的最佳试剂为________(填字母代号);
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
(3)控制滴加浓盐酸的速率,使产生的气体缓缓通过装置D,其目的是______________________________________________________________。
Ⅱ.探究ClO2的氧化性,按下图所示装置进行实验:

(4)完成下列表格中的空格:
洗气瓶 | 现象或作用 | 解释原因 |
X | 溶液由浅绿色变成棕黄色 | 反应的离子方程式为_________________ |
Y | 溶液中出现淡黄色沉淀 | 反应的离子方程式为______________ |
Z | NaOH溶液的作用是________________________ | 反应的化学方程式为 2NaOH + 2ClO2 = NaClO2 + NaClO3 + H2O |
Ⅲ.测定水中的浓度
用碘量法测定水中ClO2浓度的实验步骤:取100 mL的水样加稀硫酸调节pH至2~3,加入一定量的KI溶液,充分振荡后,再加入几滴指示剂,用2.0×10-4 mol/L标准Na2S2O3溶液进行滴定(已知:2ClO2 + 10I- + 8H+ = 5I2 + 2Cl- + 4H2O ;2S2O32- + I2 = S4O62- + 2I- )。
(5)若达到滴定终点时,消耗15.00 mL 标准Na2S2O3溶液,则水样中ClO2的浓度是 _________ mol/L。