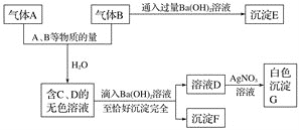
题目内容
【题目】在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理 NO 尾气通常是将 NO 与 O2 混合通入碱液中吸收。已知一定条件下有下列反应:
Ⅰ:2N2O5(g) ![]() 4NO2(g)+O2(g) △H1
4NO2(g)+O2(g) △H1
Ⅱ:2NO2(g)![]() 2NO(g)+O2(g) △H2
2NO(g)+O2(g) △H2
Ⅲ:2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) △H3
写出 NO 和O2 的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式______。
(2)常温下,NO 极易被 O2 氧化为 NO2,温度高于 423K 时,NO2 发生分解:2NO2(g) ![]() 2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
υ正=υ(NO2)消耗=k 正C2(NO2), υ逆=υ(NO)消耗=2υ(O2) 消耗=k 逆c2(NO)·c( O2),k 正、k 逆 为速率常数,受温度影响。不同温度下,将 NO2 置于体积为 VL 的密闭容器中,NO2 的物质的量的浓度与反应时间的关系如图所示:
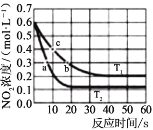
①T1 温度下 0-10s 内,O2 的反应速率υ(O2)=______、平衡常数 KT1=___________。
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采取的单一措施有______
③平衡常数KT1 ______ KT2 填“大于”“小于”或“等于”,下同);反应速率υa_______υb。
④计算 c 处υ正/υ逆=______。
(3)NO 也 可 通 过 如 下 反 应 处 理 :6NO(g)+4NH3(g) =5N2(g) +6H2O(g);一定条件下,平衡时 N2 的体积分数与压强的关系如图所示。N2 的体积分数先减小后增大的原因是______。
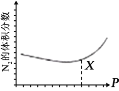
【答案】4NO(g)+3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1) △ H=2△ H3-△ H1-2△ H2 0.01molL-1s-1 0.8 molL-1 增大 NO2 的浓度(其它合理答案均可) 小于 大于 32 增大压强,平衡逆向移动,N2 的体积分数减小;X 点之后,由于压强太大,水变为液态,增大压强,平衡正向移动,N2 的体积分数增大
【解析】
(1)根据盖斯定律写出热化学方程式;
(2)①![]() ,利用三段法计算平衡常数;
,利用三段法计算平衡常数;
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采用增大 NO2 的浓度;
③温度由T1到T2时NO2平衡时浓度降低,则平衡正移,![]() ,则T1<T2;
,则T1<T2;
④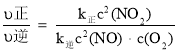 ,再根据平衡常数K和达到平衡时υ正=υ逆计算
,再根据平衡常数K和达到平衡时υ正=υ逆计算![]() ;
;
(3)由化学方程式![]() 可知,正反应为压强增大的反应,则增大压强平衡逆移,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,以此分析。
可知,正反应为压强增大的反应,则增大压强平衡逆移,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,以此分析。
(1)根据盖斯定律可得![]() 可得
可得![]() △ H=2△ H3-△ H1-2△ H2,故答案为:
△ H=2△ H3-△ H1-2△ H2,故答案为:![]() △ H=2△ H3-△ H1-2△ H2;
△ H=2△ H3-△ H1-2△ H2;
(2)①![]() ,由图像可得
,由图像可得

则平衡常数 ,故答案为:0.01molL-1s-1;0.8 molL-1;
,故答案为:0.01molL-1s-1;0.8 molL-1;
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采用增大 NO2 的浓度,故答案为:增大 NO2 的浓度;
③温度由T1到T2时NO2平衡时浓度降低,则平衡正移,则KT1< KT2;![]() ,则T1<T2,相同浓度下温度越高反应速率越快,则υa>υb,故答案为:小于;大于;
,则T1<T2,相同浓度下温度越高反应速率越快,则υa>υb,故答案为:小于;大于;
④当υ正=υ逆时,反应达到平衡,![]() ,则
,则 ,则c 处时各物质浓度如下
,则c 处时各物质浓度如下
则 ,故答案为:32;
,故答案为:32;
(3)由化学方程式![]() 可知,正反应为压强增大的反应,则增大压强平衡逆移,N2 的体积分数减小,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,N2 的体积分数增大,故答案为:增大压强,平衡逆向移动,N2 的体积分数减小;X 点之后,由于压强太大,水变为液态,增大压强,平衡正向移动,N2 的体积分数增大。
可知,正反应为压强增大的反应,则增大压强平衡逆移,N2 的体积分数减小,压强过大时,水变为液态,正反应为压强减小的反应,增大压强,平衡正移,N2 的体积分数增大,故答案为:增大压强,平衡逆向移动,N2 的体积分数减小;X 点之后,由于压强太大,水变为液态,增大压强,平衡正向移动,N2 的体积分数增大。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案