题目内容
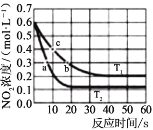
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是
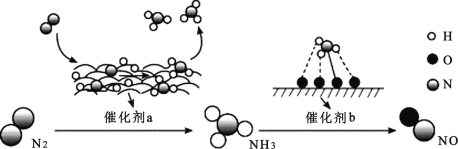
A.催化剂 a 表面发生了共价键的断裂和形成,但分子总数不变
B.在催化剂b 表面形成新的共价键时,存在微粒间的电子转移
C.N2 与H2 反应生成 NH3 的原子利用率不足 100%
D.催化剂 a、b 能提高反应的平衡转化率
【答案】B
【解析】
A.催化剂a表面是氢气和氮气反应生成氨气;
B.催化剂b表面是氨气催化氧化生成NO的反应;
C.由流程可知氮气和氢气反应,生成物只有氨气,原子利用率为100%;
D.催化剂改变反应速率不改变化学平衡。
A. 催化剂a表面是氢气和氮气反应生成氨气,![]() 催化剂a表面发生了共价键的断裂和极性键的形成,分子总数减小,故A错误;
催化剂a表面发生了共价键的断裂和极性键的形成,分子总数减小,故A错误;
B. 催化剂b表面是氨气催化氧化生成NO的反应,发生的是氧化还原反应,存在微粒间的电子转移,故B正确;
C. N2与H2反应生成NH3,反应物参加反应过程中原子利用率为100%,故C错误;
D. 催化剂a、b改变反应速率,不改变化学平衡,不能提高反应的平衡转化率,故D错误;
故答案选:B。

练习册系列答案
相关题目
【题目】根据下列实验操作、现象所得出的结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向氯水中滴加硝酸酸化的AgNO3溶液 | 产生白色沉淀 | 氯水中含有Cl﹣ |
B | 向某溶液中滴加盐酸 | 有无色气体产生 | 溶液中一定有CO32﹣ |
C | 向某溶液中加入烧碱溶液后加热,用湿润的红色石蕊试纸检验 | 石蕊试纸变蓝 | 溶液中有NH4+ |
D | 将SO2通入到酸性KMnO4溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D