题目内容
【题目】由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
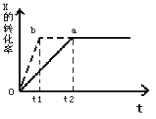
(1)氧原子核外有_____种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______。
(3)C2H4 与N2H4 在水中的溶解度相差很大, 出现这种现象的主要原因是 __________。
(4)H2C2O4 分子中碳原子的杂化类型是 _________,写出一种与 C2O42-互为等电子体的分子的化学式_______________。
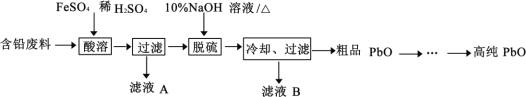
(5)NaHF2 可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2 中所含作用力的类型有___________(填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
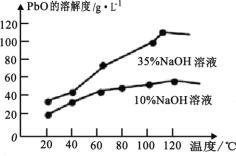
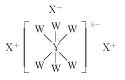
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______g·cm -3(阿伏加德罗常数的值为 NA,用含 a、b、NA 的代数式表示)

【答案】8 3 ![]() C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在 sp2 N2O4(或其他合理答案) abd BN
C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在 sp2 N2O4(或其他合理答案) abd BN 
【解析】
(1)核外没有运动状态相同的电子;有1s轨道、2s轨道、3个能量相同的2p轨道;
(2)N 原子外围电子排布式为:2s22p3,Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,则Bi原子外围电子排布式为:6s26p3,以此写出基态 Bi 原子的价电子轨道排布图;
(3)N2H4 与H2O 之间有氢键存在;
(4)根据价层电子对互斥理论分析H2C2O4 分子中碳原子的杂化类型;C2O42-含有46个电子;
(5)NaHF2中含有离子键、共价键,F的电负性较强,还存在氢键;
(6)利用均摊法计算晶胞中N原子和B原子数目,以此写出化学式;而晶胞密度![]() 联立计算。
联立计算。
(1)氧原子核外有8个电子,核外没有运动状态相同的电子,则有8种不同运动状态的电子;有1s轨道、2s轨道、3个能量相同的2p轨道,共三种不同能量的原子轨道,故答案为:8;3;
(2)N 原子外围电子排布式为:2s22p3,Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,则Bi原子外围电子排布式为:6s26p3,则基态 Bi 原子的价电子轨道排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在,则N2H4在水中的溶解度比C2H4在水中溶解度大,故答案为:C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在;
(4)H2C2O4 分子中碳原子含有3个σ键,无孤电子对,则H2C2O4 分子中碳原子的杂化类型是sp2;C2O42-含有46个电子,与 C2O42-互为等电子体的分子的化学式有N2O4,故答案为sp2;N2O4(或其他合理答案);
(5)NaHF2中含有离子键、共价键,F的电负性较强,还存在氢键,故答案为:abd;
(6)晶胞中N原子个数为![]() ,B原子数目为:
,B原子数目为:![]() ,氮化硼的化学式为BN;晶胞质量
,氮化硼的化学式为BN;晶胞质量![]() ,晶胞体积
,晶胞体积![]() 晶胞密度
晶胞密度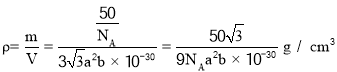 ,故答案为:BN;
,故答案为:BN;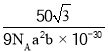 。
。