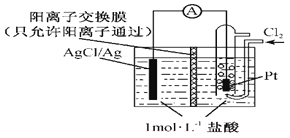
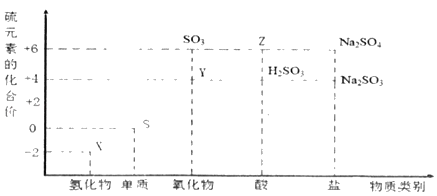
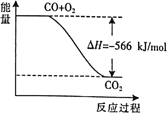
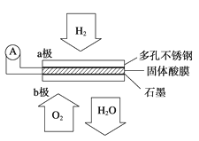
题目内容
【题目】室温下,甘氨酸在水溶液中主要以 、
、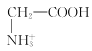 和
和![]() 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
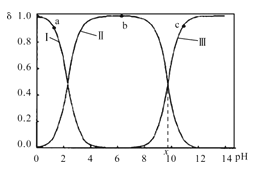
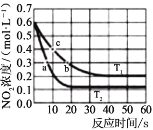
A.a点溶液中,水的电离程度大于b点
B.c点溶液中,c(![]() )>c(
)>c( )
)
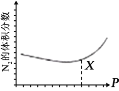
C.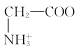 +H2O
+H2O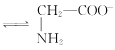 +H3O+的平衡常数为x
+H3O+的平衡常数为x
D.a点溶液中,存在关系式:c(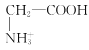 )+c(H+)=c(
)+c(H+)=c(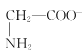 )+c(OH-)
)+c(OH-)
【答案】B
【解析】
氨基具碱性,在酸性较强时会结合氢离子,羧基具酸性,在碱性较强时与氢氧根反应,故曲线Ⅰ为 、曲线Ⅱ为
、曲线Ⅱ为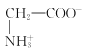 、曲线Ⅲ为
、曲线Ⅲ为![]() ,据此回答。
,据此回答。
A. a点溶液酸性较强,甘氨酸主要以 存在,b点接近中性,甘氨酸主要以内盐
存在,b点接近中性,甘氨酸主要以内盐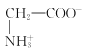 形式存在,a点水的电离被抑制程度大,A错误;
形式存在,a点水的电离被抑制程度大,A错误;
B. c点溶液中,碱性较强,甘氨酸主要以![]() 存在, c(
存在, c(![]() )>c(
)>c(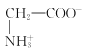 ),B正确;
),B正确;
C. 曲线Ⅱ和Ⅲ的交点时,即pH=x时,溶液中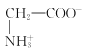 与
与![]() 浓度相等,溶液中c(H+)=10-xmol/L,K=10-x,C错误;
浓度相等,溶液中c(H+)=10-xmol/L,K=10-x,C错误;
D. a点溶液中,不存在存在 ,D错误;
,D错误;
答案选B。

练习册系列答案
相关题目