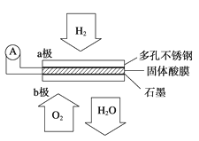
题目内容
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
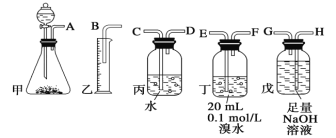
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项);
A. 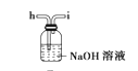
B.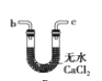
C.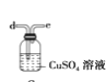
D.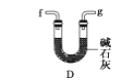
(7)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:纯净乙炔气 ![]() 混合液
混合液 ![]() 有机混合物Ⅰ
有机混合物Ⅰ ![]() 混合液
混合液 ![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
【答案】CaC2+2H2O![]() Ca(OH)2+C2H2↑ AHGEFDCB 饱和食盐水
Ca(OH)2+C2H2↑ AHGEFDCB 饱和食盐水 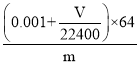 ×100% 偏高 H2S+Br2=S↓+2HBr BD 蒸馏(或分馏) CH2=CHBr、CH3-CHBr2、CH2Br-CH2Br
×100% 偏高 H2S+Br2=S↓+2HBr BD 蒸馏(或分馏) CH2=CHBr、CH3-CHBr2、CH2Br-CH2Br
【解析】
(1)CaC2和水反应生成氢氧化钙和乙炔,化学方程式为:CaC2+2H2O![]() Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O
Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O![]() Ca(OH)2+C2H2↑;
Ca(OH)2+C2H2↑;
(2)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积,所以正确的连接顺序为:AHGEFDCB;
故答案为:AHGEFDCB;
(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
故答案为:饱和食盐水;
(4)溴水与乙炔恰好完全反应生成C2H2Br4,溴单质的物质的量为0.1mol/L×0.02L=0.002mol,消耗的乙炔为:0.001mol,测得排入量筒内液体体积为VmL(标况),则乙炔的体积为Vml,其物质的量为![]() ;
;
所以乙炔的总物质的量为0.001mol+![]() mol,
mol,
由CaC2+2H2O![]() Ca(OH)2+C2H2↑可知CaC2的物质的量0.001mol+
Ca(OH)2+C2H2↑可知CaC2的物质的量0.001mol+![]() mol,质量为(0.001+
mol,质量为(0.001+![]() )×64g;所以电石纯度可表示为
)×64g;所以电石纯度可表示为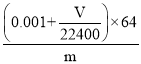 ×100%;
×100%;
故答案为: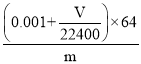 ×100%;
×100%;
(5)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多,最终测得电石的纯度偏高,发生的反应为H2S+Br2=S↓+2HBr;
故答案为:偏高;H2S+Br2=S↓+2HBr;
(6) 干燥乙炔气体主要是除去乙炔中的水分,同时除去混有的少量硫化氢,A和C能除去硫化氢,但是不能除去水。B和D装置都可以吸水,D装置还能除去硫化氢;
答案选BD。
(7)①分离有机物一般是根据其沸点差异,采用蒸馏或分馏方法;
答案为:蒸馏或分馏
②CH≡CH与HBr发生加成反应时,若CH≡CH中断裂一个键,则与HBr加成可得CH2═CHBr,CH2═CHBr能继续与HBr加成得到CH3-CHBr2、BrCH2-CH2Br。
答案为:CH2═CHBr、CH3-CHBr2、CH2Br-CH2Br