题目内容
【题目】.研究表明: CO2和 CO可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机。
(1)目前工业上有一种方法是用 CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
反应 I: CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H =+41.3kJ·mol -1
CO(g)+ H2O(g) △H =+41.3kJ·mol -1
反 应 II: 2CO(g)+ 4H2(g) ![]() C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
①CO2加氢合成乙烯的热化学方程式为_____。
②一定条件下的密闭容器中,上述反应 I 达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是_____(填字母)。
A.减小压强
B 分离出水蒸气.
C.加入适当催化剂
D.增大 H2浓度
E.升高温度
(2)将不同物质的量的H2O(g)和 CO(g)分别通入体积为 2 L 的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/ mol | 平衡量/ mol | 达到平衡所 需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | a | b | c | d | t |
若 a=2,b=1,则 c=_____,达到平衡时实验组Ⅱ中 H2O(g)和实验组Ⅲ中 CO的转化率的关系为 αⅡ(H2O)_____(填“<”“>”或“=”)αⅢ(CO)。
(3)可以用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
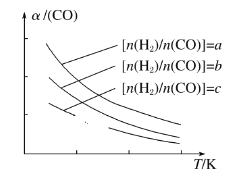
①a、b、c 按从大到小的顺序排序为_____
②根据图像可以判断该反应为放热反应,理由是_________________
(4)工业上还可利用 CO或 CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2 | K2 | 1.0 | 2.50 |
③3H2(g)+CO2 | K3 | ||
据反应①与②可推导出 K1、K2 与 K3之间的关系,则 K3=_____(用 K1、K2 表示); 反应③的ΔH_____(填“>”或“<”)0。
【答案】2CO2+6H2(g)![]() C2H4(g)+4H2O(g) △H= -127.9 kJ/mol DE 0.6 = a>b>c 投料比相同,温度越高,α(CO)越小,平衡左移,该反应为放热反应 K1·K2 <
C2H4(g)+4H2O(g) △H= -127.9 kJ/mol DE 0.6 = a>b>c 投料比相同,温度越高,α(CO)越小,平衡左移,该反应为放热反应 K1·K2 <
【解析】
(1)①根据盖斯定律计算;
②要加快反应速率并提高 CO2 的转化率,可以增大反应物H2的浓度,使平衡右移;
(2)由Ⅱ可得反应的平衡常数K=![]() =
=![]() =0.167,通过列方程式写出方程式可以解出c的值;
=0.167,通过列方程式写出方程式可以解出c的值;
(3)①增大H2的浓度,平衡右移,CO的转化率增大,故有a>b>c;
②通过图可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应;
(4)![]() ,
,![]() ,
,![]() ,
,![]() ;
;
(5)根据(3)可得K3(500℃)= K1·K2=2.5×1.0=2.50;K3(800℃)= K1·K2=0.15×2.50=0.375;升高温度,平衡常数减小,反应放热,ΔH<0。
(1) ①已知:I.CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.3kJ/mol
CO(g)+H2O(g)△H=+41.3kJ/mol
II.2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g)△H=-210.5kJ/mol
C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根据盖斯定律,I![]() 2+II可得:2CO2(g)+6H2(g)
2+II可得:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H= -127.9kJ/mol,因此,本题正确答案是:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g)△H= -127.9kJ/mol,因此,本题正确答案是:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H= -127.9kJ/mol;
C2H4(g)+4H2O(g)△H= -127.9kJ/mol;
②A.正反应为气体体积减小的反应,低压有利于逆向进行,CO2的转化率减小,故A错误;
B. 分离出水蒸气,生成物浓度减小,平衡正向移动,CO2的转化率增大,但反应速率减小,故B错误;
C. 加入合适的催化剂,可以加快反应速率,但不影响平衡移动,CO2的转化率不变,故C错误;
D. 增大 H2浓度,平衡正向移动,CO2的转化率增大,反应速率增大,故D正确;
E. 升高温度反应速率增大;反应CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H =+41.3kJ·mol -1吸热,升高温度平衡正向移动,CO
CO(g)+ H2O(g) △H =+41.3kJ·mol -1吸热,升高温度平衡正向移动,CO
因此,本题正确答案是:DE;
(2)由Ⅱ可得反应的平衡常数K=![]() =
=![]() =0.167实验Ⅲ中有
=0.167实验Ⅲ中有
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol)2 1 0 0
转化(mol)x x x x
平衡(mol)2-x 1-x x x
带入K=![]() =
=![]() =0.167,解得x=0.4,则平衡时n(CO)=c=1-x=0.6mol;实验组Ⅱ中 H2O(g) 的转化率αⅡ(H2O)=
=0.167,解得x=0.4,则平衡时n(CO)=c=1-x=0.6mol;实验组Ⅱ中 H2O(g) 的转化率αⅡ(H2O)= ![]() ×100%=40%,实验组Ⅲ中 CO的转化率αⅢ(CO)=
×100%=40%,实验组Ⅲ中 CO的转化率αⅢ(CO)= ![]() ×100%=40%,故αⅡ(H2O)= αⅢ(CO);
×100%=40%,故αⅡ(H2O)= αⅢ(CO);
(3)①增大H2的浓度,平衡右移,CO的转化率增大,故有a>b>c,故答案为:a>b>c;
②通过图可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应。
(4)![]() ,
,![]() ,
,![]() ,
,![]() ,故正确答案是:K1·K2;
,故正确答案是:K1·K2;
(5)根据(3)可得K3(500℃)= K1·K2=2.5×1.0=2.50;K3(800℃)= K1·K2=0.15×2.50=0.375;升高温度,平衡常数减小,反应放热,ΔH<0。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】(1)某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):____→ → F → → → → D。
(2)操作F中应该选择图中滴定管_____(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_____。
(4)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为_____(精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_____。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
Ⅰ、写出用KMn04滴定H2C2O4的离子方程式_____________________。
Ⅱ、判断滴定终点的方法是________________________。
Ⅲ、计算:血液中含钙离子的浓度为_____mol/L。