题目内容
【题目】已知:C(s)的燃烧热△H = —393.5kJ·mol—1,C(s)+ ![]() O2 (g) = CO(g) △H = —110.5kJ·mol—1。测得某次实验中m g炭粉燃烧所得气体中,CO 和 CO2的体积比为1:2,则与这些炭完全燃烧(只生成CO2)相比较,损失的能量是
O2 (g) = CO(g) △H = —110.5kJ·mol—1。测得某次实验中m g炭粉燃烧所得气体中,CO 和 CO2的体积比为1:2,则与这些炭完全燃烧(只生成CO2)相比较,损失的能量是
A.![]() kJB.
kJB.![]() kJC.
kJC.![]() kJD.
kJD.![]() kJ
kJ
【答案】D
【解析】
碳不完全燃烧损失的热量为生成的CO燃烧放出的热量,根据碳原子守恒计算出CO的物质的量,再根据CO燃烧的热化学方程式计算。
mg碳的物质的量为![]() mol,由于CO和CO2的体积比为1:2,根据碳原子守恒得CO的物质的量为
mol,由于CO和CO2的体积比为1:2,根据碳原子守恒得CO的物质的量为![]() mol×
mol×![]() =
=![]() mol;由C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,C(s)+
mol;由C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,C(s)+![]() O2(g)=CO(g) △H=-110.5kJ·mol-1,得CO(g)+
O2(g)=CO(g) △H=-110.5kJ·mol-1,得CO(g)+![]() O2(g)= CO2(g) △H=(-393.5kJ·mol-1)- (-110.5kJ·mol-1)=-283.0kJ·mol-1,即1molCO完全燃烧放出的热量为283.0kJ,则
O2(g)= CO2(g) △H=(-393.5kJ·mol-1)- (-110.5kJ·mol-1)=-283.0kJ·mol-1,即1molCO完全燃烧放出的热量为283.0kJ,则![]() molCO完全燃烧放出的热量为
molCO完全燃烧放出的热量为![]() ×283.0kJ=
×283.0kJ=![]() kJ,故答案选D。
kJ,故答案选D。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】.研究表明: CO2和 CO可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机。
(1)目前工业上有一种方法是用 CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
反应 I: CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H =+41.3kJ·mol -1
CO(g)+ H2O(g) △H =+41.3kJ·mol -1
反 应 II: 2CO(g)+ 4H2(g) ![]() C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
①CO2加氢合成乙烯的热化学方程式为_____。
②一定条件下的密闭容器中,上述反应 I 达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是_____(填字母)。
A.减小压强
B 分离出水蒸气.
C.加入适当催化剂
D.增大 H2浓度
E.升高温度
(2)将不同物质的量的H2O(g)和 CO(g)分别通入体积为 2 L 的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/ mol | 平衡量/ mol | 达到平衡所 需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | a | b | c | d | t |
若 a=2,b=1,则 c=_____,达到平衡时实验组Ⅱ中 H2O(g)和实验组Ⅲ中 CO的转化率的关系为 αⅡ(H2O)_____(填“<”“>”或“=”)αⅢ(CO)。
(3)可以用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。

①a、b、c 按从大到小的顺序排序为_____
②根据图像可以判断该反应为放热反应,理由是_________________
(4)工业上还可利用 CO或 CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2 | K2 | 1.0 | 2.50 |
③3H2(g)+CO2 | K3 | ||
据反应①与②可推导出 K1、K2 与 K3之间的关系,则 K3=_____(用 K1、K2 表示); 反应③的ΔH_____(填“>”或“<”)0。
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列问题:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置______,基态E2+价电子的排布图为_______,B元素能量最高的电子其轨道呈_______形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________,B、C、D简单离子的半径由大到小的顺序为_________。
(4)写出C的核外有18个电子的氢化物的电子式________。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________。
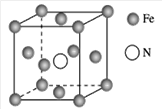
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。