题目内容
【题目】氢气的摩尔质量为M g·mol-1,密度是ρ g·L-1,阿伏加德罗常数为NA,则下列表述正确的是
A.单位体积中所含氢气分子数目![]()
B.单位质量中所含氢气分子数目为ρ·NA
C.单个氢气分子的质量为![]() g
g
D.单个氢气分子占有的体积为![]() L
L
【答案】C
【解析】
结合n=![]() 以及ρ=
以及ρ=![]() 计算。
计算。
A.由于没有明确气体存在的条件,则气体摩尔体积不一定为22.4L/mol,则单位体积中所含氢气分子数目不一定为![]() ,故A错误;
,故A错误;
B.单位质量中所含氢气分子数目为![]() ×NA/mol=
×NA/mol= ![]() ,故B错误;
,故B错误;
C.1mol氢气的质量为M g,则每个氢气分子的质量为![]() g,故C正确;
g,故C正确;
D.没有告诉在标况下,不能使用标况下的气体摩尔体积计算每个氢气分子所占体积,故D错误;
故选:C。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】I.有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)D﹣的结构示意图是___。
(2)C元素的气态氢化物的化学式为:___;其检验方法:___。
(3)B元素在周期表中的位置___;离子半径:B___A(填“大于”或“小于”)。
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___,与D的氢化物的水化物反应的离子方程式为___。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)NO的平衡浓度c/span>(NO)=___。
(2)图中表示NO2变化的曲线是___,用O2表示0~2s内该反应的平均速率υ=___。
(3)能说明该反应已达到平衡状态的是___。
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变
【题目】.研究表明: CO2和 CO可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机。
(1)目前工业上有一种方法是用 CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
反应 I: CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H =+41.3kJ·mol -1
CO(g)+ H2O(g) △H =+41.3kJ·mol -1
反 应 II: 2CO(g)+ 4H2(g) ![]() C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
①CO2加氢合成乙烯的热化学方程式为_____。
②一定条件下的密闭容器中,上述反应 I 达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是_____(填字母)。
A.减小压强
B 分离出水蒸气.
C.加入适当催化剂
D.增大 H2浓度
E.升高温度
(2)将不同物质的量的H2O(g)和 CO(g)分别通入体积为 2 L 的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/ mol | 平衡量/ mol | 达到平衡所 需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | a | b | c | d | t |
若 a=2,b=1,则 c=_____,达到平衡时实验组Ⅱ中 H2O(g)和实验组Ⅲ中 CO的转化率的关系为 αⅡ(H2O)_____(填“<”“>”或“=”)αⅢ(CO)。
(3)可以用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
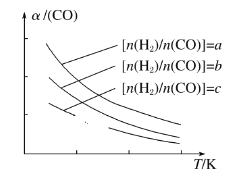
①a、b、c 按从大到小的顺序排序为_____
②根据图像可以判断该反应为放热反应,理由是_________________
(4)工业上还可利用 CO或 CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2 | K2 | 1.0 | 2.50 |
③3H2(g)+CO2 | K3 | ||
据反应①与②可推导出 K1、K2 与 K3之间的关系,则 K3=_____(用 K1、K2 表示); 反应③的ΔH_____(填“>”或“<”)0。